ประเภท: บทความเด่น » ช่างไฟฟ้าสามเณร
จำนวนการดู: 70526
ความเห็นเกี่ยวกับบทความ: 0
เซลล์กัลวานิก - อุปกรณ์หลักการทำงานชนิดและคุณสมบัติหลัก
สิ่งที่จำเป็นต้องมีสำหรับการปรากฏตัวของเซลล์กัลวานิค ประวัติเล็กน้อย ในปี ค.ศ. 1786 ศาสตราจารย์แพทย์ศาสตร์ชาวอิตาเลียน Luigi Aloisio Galvani ค้นพบปรากฏการณ์ที่น่าสนใจ: กล้ามเนื้อของขาหลังของศพที่เปิดใหม่ของกบที่แขวนอยู่บนตะขอทองแดงที่หดตัวเมื่อนักวิทยาศาสตร์ได้สัมผัสพวกเขาด้วยมีดผ่าตัดเหล็ก Galvani ทันทีสรุปว่านี่คือการรวมตัวกันของ "สัตว์ไฟฟ้า"
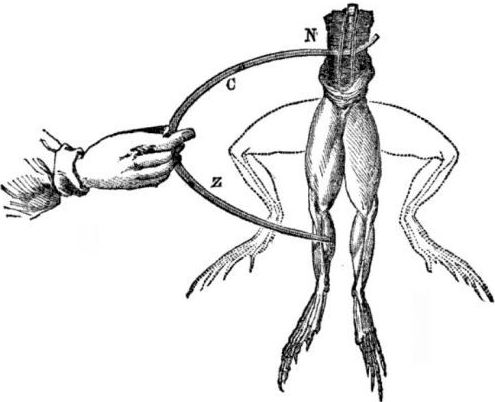
หลังจากการเสียชีวิตของ Galvani, Alessandro Volta ในปัจจุบันของเขาในฐานะนักเคมีและนักฟิสิกส์จะอธิบายและแสดงให้เห็นถึงกลไกที่สมจริงยิ่งขึ้นสำหรับการเกิดกระแสไฟฟ้าเมื่อโลหะต่างชนิดเข้ามาสัมผัส
Volta หลังจากการทดลองหลายครั้งจะได้ข้อสรุปที่ชัดเจนว่ากระแสไฟฟ้าปรากฏในวงจรเนื่องจากมีตัวนำไฟฟ้าสองตัวที่เป็นโลหะอยู่ในของเหลวและนี่ไม่ใช่ "กระแสไฟฟ้าของสัตว์" ตามที่ Galvani คิด การกระตุกของขาของกบเป็นผลมาจากการกระทำของกระแสที่เกิดจากการสัมผัสของโลหะต่าง ๆ (ตะขอทองแดงและมีดผ่าตัดเหล็ก)
Volta จะแสดงปรากฏการณ์เดียวกับที่ Galvani แสดงบนกบที่ตายแล้ว แต่ในอิเล็กโตรมิเตอร์แบบโฮมเมดที่ไม่มีชีวิตอย่างสมบูรณ์และในปี 1800 จะให้คำอธิบายที่แม่นยำของกระแสไฟฟ้า:“ ตัวนำที่สอง (ของเหลว) อยู่กลางและสัมผัสกับตัวนำสองชั้น โลหะ ... ด้วยเหตุนี้กระแสไฟฟ้าของทิศทางเดียวหรืออีกอันหนึ่งเกิดขึ้น”

ในการทดลองแรกครั้งหนึ่ง Volta ได้ลดแผ่นโลหะสองชิ้นคือสังกะสีและทองแดงลงในขวดกรดและเชื่อมต่อกับลวด หลังจากนั้นแผ่นสังกะสีก็เริ่มละลายและฟองก๊าซที่เกิดขึ้นบนเหล็กทองแดง Volta แนะนำและพิสูจน์ว่ากระแสไฟฟ้าไหลผ่านลวด
ดังนั้นจึงได้คิดค้น "องค์ประกอบ Volta" - เซลล์กัลวานิกแห่งแรก เพื่อความสะดวก Volta ทำให้เขามีรูปทรงกระบอกแนวตั้ง (เสา) ซึ่งประกอบด้วยวงแหวนที่เชื่อมต่อกันของสังกะสีทองแดงและผ้าชุบด้วยกรด เสาโวลต์สูงครึ่งเมตรสร้างแรงดันไฟฟ้าที่ไวต่อมนุษย์
ตั้งแต่จุดเริ่มต้นของการวิจัยถูกวางโดย Luigi Galvani ชื่อ แหล่งเคมีในปัจจุบัน เก็บรักษาความทรงจำของเขาไว้ในชื่อของเขา
เซลล์กัลวานิค เป็นแหล่งเคมีของกระแสไฟฟ้าโดยอาศัยการทำงานร่วมกันของโลหะสองชนิดและ / หรือออกไซด์ในอิเล็กโทรไลต์ซึ่งนำไปสู่การปรากฏตัวของกระแสไฟฟ้าในวงจรปิด ดังนั้นในเซลล์กัลวานิคพลังงานเคมีจะถูกแปลงเป็นพลังงานไฟฟ้า
เซลล์วันนี้

เซลล์วันนี้เรียกว่าแบตเตอรี่ แบตเตอรี่สามประเภทแพร่หลาย: น้ำเกลือ (แห้ง), อัลคาไลน์ (เรียกอีกอย่างว่าอัลคาไลน์, "อัลคาไลน์" ในการแปลจากภาษาอังกฤษ - "อัลคาไลน์") และลิเธียม หลักการทำงานของพวกเขาเหมือนกับที่อธิบายไว้โดย Volta ในปี 1800: โลหะสองชนิด ทำปฏิกิริยาผ่านอิเล็กโทรไลต์และกระแสไฟฟ้าเกิดขึ้นในวงจรปิดภายนอก
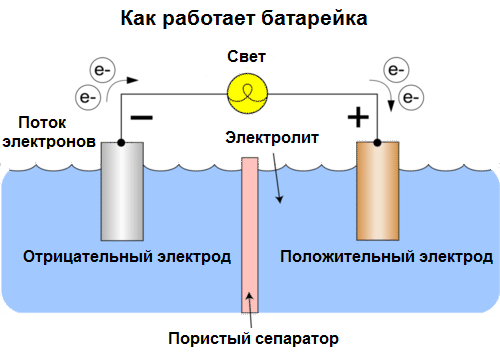
แรงดันไฟฟ้าของแบตเตอรี่ขึ้นอยู่กับโลหะที่ใช้และจำนวนเซลล์ใน "แบตเตอรี่" แบตเตอรี่ซึ่งแตกต่างจากแบตเตอรี่ไม่สามารถกู้คืนคุณสมบัติได้เนื่องจากพวกเขาแปลงพลังงานเคมีโดยตรงนั่นคือพลังงานของรีเอเจนต์ (รีดักท์และอ๊อกซิไดเซอร์) ที่รวมกันเป็นพลังงานไฟฟ้า
รีเอเจนต์ที่รวมอยู่ในแบตเตอรีจะถูกใช้ไปในระหว่างการทำงานกระแสไฟจะค่อยๆลดลงดังนั้นการกระทำของแหล่งกำเนิดจะสิ้นสุดลงหลังจากรีเอเจนต์ตอบสนองอย่างสมบูรณ์
ส่วนประกอบอัลคาไลน์และเกลือ (แบตเตอรี่) ใช้กันอย่างแพร่หลายในการจ่ายพลังงานให้กับอุปกรณ์อิเล็กทรอนิกส์อุปกรณ์วิทยุของเล่นและลิเธียมส่วนใหญ่สามารถพบได้ในอุปกรณ์ทางการแพทย์แบบพกพาเช่นเครื่องวัดระดับน้ำตาลในเลือดหรือเทคโนโลยีดิจิตอลเช่นกล้อง

แบตเตอรี่เกลือ
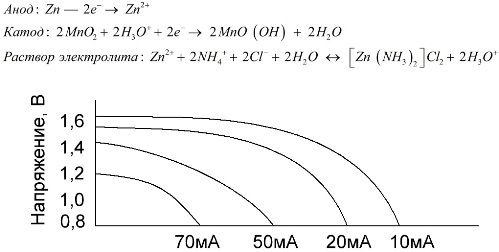
เซลล์แมงกานีสสังกะสีซึ่งเรียกว่าแบตเตอรี่เกลือเป็นเซลล์กัลวานิกแบบ“ แห้ง” ซึ่งภายในไม่มีสารละลายอิเล็กโทรไลต์เหลว
อิเล็กโทรดสังกะสี (+) เป็นแคโทดรูปถ้วยและมีส่วนผสมของผงแมงกานีสไดออกไซด์และกราไฟต์ทำหน้าที่เป็นขั้วบวก กระแสไหลผ่านแท่งกราไฟท์ ในฐานะที่เป็นอิเล็กโทรไลต์วางใช้จากสารละลายของแอมโมเนียมคลอไรด์ด้วยการเติมแป้งหรือแป้งให้ข้นจึงไม่มีอะไรไหล
โดยทั่วไปผู้ผลิตแบตเตอรี่ไม่ได้ระบุองค์ประกอบที่แน่นอนขององค์ประกอบเกลืออย่างไรก็ตามแบตเตอรี่เกลือมีราคาถูกที่สุดมักใช้ในอุปกรณ์ที่มีการใช้พลังงานต่ำมาก: ในชั่วโมงในการควบคุมระยะไกลในเครื่องวัดอุณหภูมิอิเล็กทรอนิกส์ ฯลฯ

แนวคิดของ "ความจุปกติ" ไม่ค่อยถูกใช้เพื่อจำแนกลักษณะของแบตเตอรี่แมงกานีส - สังกะสีเนื่องจากความจุขึ้นอยู่กับสภาพการทำงานและเงื่อนไข ข้อเสียเปรียบหลักขององค์ประกอบเหล่านี้คืออัตราการลดลงของแรงดันไฟฟ้าที่สำคัญตลอดการคายประจุและการลดลงอย่างมีนัยสำคัญในความจุเอาต์พุตที่มีการปล่อยกระแสเพิ่มขึ้น แรงดันไฟฟ้าการปล่อยสุดท้ายถูกตั้งค่าขึ้นอยู่กับโหลดในช่วง 0.7-1.0 V
เป็นสิ่งสำคัญไม่เพียง แต่ขนาดของกระแสไฟฟ้าเท่านั้น แต่ยังรวมถึงกำหนดเวลาของการโหลดด้วย ด้วยการคายประจุเป็นระยะ ๆ ของกระแสไฟฟ้าขนาดใหญ่และขนาดกลางประสิทธิภาพของแบตเตอรี่จะเพิ่มขึ้นอย่างเด่นชัดเมื่อเทียบกับการทำงานต่อเนื่อง อย่างไรก็ตามด้วยกระแสคายประจุขนาดเล็กและการหยุดชะงักเป็นเวลาหลายเดือนในการดำเนินงานความจุของกระแสไฟฟ้าอาจลดลงเนื่องจากการคายประจุเอง
กราฟด้านบนแสดงกราฟการคายประจุสำหรับแบตเตอรี่เกลือเฉลี่ยสำหรับ 4, 10, 20 และ 40 ชั่วโมงสำหรับการเปรียบเทียบกับอัลคาไลน์หนึ่งซึ่งจะกล่าวถึงในภายหลัง
แบตเตอรี่อัลคาไลน์ (อัลคาไลน์)
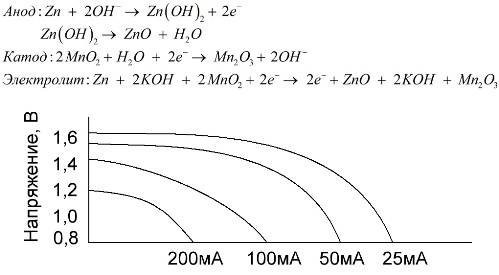
แบตเตอรี่อัลคาไลน์คือแบตเตอรี่กัลวาไนซ์แมงกานีสซึ่งมีแมงกานีสไดออกไซด์ถูกใช้เป็นแคโทดจะใช้ผงสังกะสีเป็นขั้วบวกและสารละลายอัลคาไลจะใช้เป็นอิเล็กโทรไลต์มักจะอยู่ในรูปของโพแทสเซียมไฮดรอกไซด์
แบตเตอรี่เหล่านี้มีข้อดีหลายประการ (โดยเฉพาะความจุที่มีขนาดใหญ่ขึ้นอย่างมากประสิทธิภาพที่ดีขึ้นที่อุณหภูมิต่ำและกระแสโหลดสูง)

แบตเตอรี่อัลคาไลน์เปรียบเทียบกับแบตเตอรี่เกลือสามารถให้กระแสได้นานขึ้น กระแสที่มากขึ้นสามารถเกิดขึ้นได้เนื่องจากสังกะสีถูกใช้ที่นี่ไม่ได้อยู่ในรูปแบบของแก้ว แต่ในรูปแบบของผงที่มีพื้นที่สัมผัสที่ใหญ่กว่าด้วยอิเล็กโทรไลต์ โพแทสเซียมไฮดรอกไซด์ในรูปแบบของการวางใช้เป็นอิเล็กโทรไลต์
ต้องขอบคุณความสามารถของเซลล์กัลวานิคชนิดนี้ที่จะส่งมอบกระแสไฟที่สำคัญ (สูงถึง 1 A) เป็นเวลานานทำให้แบตเตอรี่อัลคาไลน์เป็นที่นิยมมากที่สุดในปัจจุบัน
ในของเล่นไฟฟ้าอุปกรณ์ทางการแพทย์แบบพกพาในอุปกรณ์อิเล็กทรอนิกส์ในกล้องแบตเตอรี่อัลคาไลน์ถูกนำมาใช้ทุกที่ พวกมันทำหน้าที่ได้นานกว่าน้ำเกลือถึง 1.5 เท่าหากปล่อยออกมามีกระแสไฟฟ้าต่ำ กราฟแสดงเส้นโค้งการปล่อยที่กระแสต่าง ๆ เพื่อเปรียบเทียบกับแบตเตอรี่เกลือ (กราฟที่ให้ไว้ด้านบน) เป็นเวลา 4, 10, 20 และ 40 ชั่วโมง
แบตเตอรี่ลิเธียม
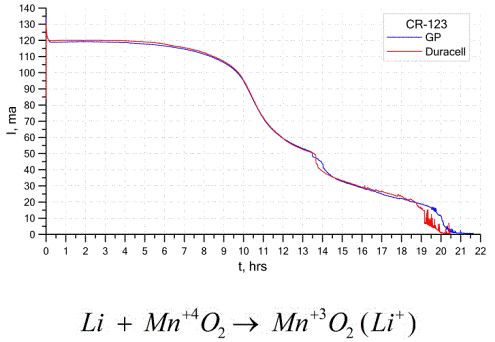
เซลล์กัลวานิกประเภทอื่นที่พบได้ทั่วไปก็คือแบตเตอรี่ลิเธียมซึ่งเป็นเซลล์กัลวานิคแบบไม่ชาร์จซึ่งมีการใช้ลิเทียมหรือสารประกอบในการเป็นขั้วบวก เนื่องจากการใช้โลหะอัลคาไลพวกเขามีความแตกต่างที่มีศักยภาพสูง

แคโทดและอิเล็กโทรไลต์ของเซลล์ลิเธียมอาจแตกต่างกันมากดังนั้นคำว่า "เซลล์ลิเธียม" จะรวมกลุ่มของเซลล์กับวัสดุแอโนดเดียวกันยกตัวอย่างเช่นแคโทดสามารถใช้แมงกานีสไดออกไซด์คาร์บอนโมโนฟลูออไรด์ไพไรต์ไธโอนิลคลอไรด์และอื่น ๆ
แบตเตอรี่ลิเธียมมีความแตกต่างจากแบตเตอรี่อื่น ๆ โดยมีค่าใช้จ่ายสูงและค่าใช้จ่ายสูง ขึ้นอยู่กับขนาดที่เลือกและวัสดุเคมีที่ใช้แบตเตอรี่ลิเธียมสามารถผลิตแรงดันไฟฟ้าจาก 1.5 V (เข้ากันได้กับแบตเตอรี่อัลคาไลน์) ถึง 3.7 V
แบตเตอรี่เหล่านี้มีความจุสูงสุดต่อหนึ่งหน่วยมวลและอายุการเก็บนาน เซลล์ลิเธียมถูกนำมาใช้กันอย่างแพร่หลายในอุปกรณ์อิเล็กทรอนิกส์พกพาที่ทันสมัย: สำหรับเปิดเครื่องนาฬิกาบนเมนบอร์ดคอมพิวเตอร์, สำหรับเปิดเครื่องอุปกรณ์ทางการแพทย์แบบพกพา, นาฬิกา, เครื่องคิดเลข, ในอุปกรณ์ถ่ายภาพ ฯลฯ
กราฟด้านบนแสดงเส้นโค้งการปล่อยสำหรับแบตเตอรี่ลิเธียมสองก้อนจากผู้ผลิตยอดนิยมสองราย กระแสเริ่มต้นคือ 120 mA (ต่อตัวต้านทานของคำสั่งของ 24 โอห์ม)
ดูเพิ่มเติมที่: แบตเตอรี่แบบชาร์จใหม่ได้ - ข้อดีและข้อเสีย
ดูได้ที่ e.imadeself.com
: