ประเภท: ช่างไฟฟ้าสามเณร, ช่างไฟฟ้าอุตสาหกรรม
จำนวนการดู: 37528
ความเห็นเกี่ยวกับบทความ: 0
การประยุกต์ใช้กระแสไฟฟ้า
เมื่อกระแสไฟฟ้าผ่านสารละลายหรืออิเล็กโทรไลต์ละลายอิเล็กโทรดที่ละลายหรือสารอื่น ๆ ที่เป็นผลิตภัณฑ์ของปฏิกิริยารองบนอิเล็กโทรดจะถูกปล่อยออกมาบนอิเล็กโทรด กระบวนการทางเคมีฟิสิกส์นี้เรียกว่าอิเล็กโทรไลซิส
สาระสำคัญของกระแสไฟฟ้า
ในสนามไฟฟ้าที่สร้างขึ้นโดยอิเล็กโทรดอิออนในของเหลวนำไฟฟ้าจะเคลื่อนที่เป็นลำดับ ขั้วลบเป็นขั้วลบบวกคือขั้วบวก
ประจุลบเรียกว่าแอนไอออน (ไอออนของไฮดรอกซิลและสารตกค้างของกรด) วิ่งไปที่ขั้วบวกและไอออนบวกที่เรียกว่าไอออนบวก (ไฮโดรเจนโลหะแอมโมเนียมไอออน ฯลฯ ) วิ่งไปที่แคโทด
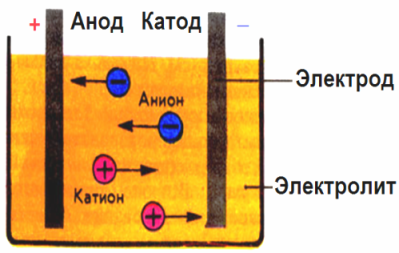
กระบวนการลดการเกิดออกซิเดชันเกิดขึ้นที่ขั้วไฟฟ้า: การลดลงของอนุภาคทางเคมีไฟฟ้า (อะตอม, โมเลกุล, ไพเพอร์) เกิดขึ้นที่แคโทดและการเกิดออกซิเดชันทางเคมีไฟฟ้าของอนุภาค (อะตอม, โมเลกุล, แอนไอออน) ที่ขั้วบวก ปฏิกิริยาการแตกตัวในอิเล็กโทรไลต์เป็นปฏิกิริยาหลักและปฏิกิริยาที่เกิดขึ้นโดยตรงที่อิเล็กโทรดเรียกว่าทุติยภูมิ
กฎของกระแสไฟฟ้าฟาราเดย์
การแยกปฏิกิริยาทางอิเล็กโทรไลซิสเป็นหลักและรองช่วยให้ไมเคิลฟาราเดย์สร้างกฎของการแยกด้วยไฟฟ้า:
-
กฎข้อที่หนึ่งของการแยกด้วยกระแสไฟฟ้าฟาราเดย์: มวลของสารที่สะสมบนอิเล็กโทรดในช่วงอิเล็กโทรไลซิสนั้นเป็นสัดส่วนโดยตรงกับปริมาณไฟฟ้าที่ส่งไปยังขั้วไฟฟ้านี้ โดยปริมาณไฟฟ้าหมายถึงประจุไฟฟ้าที่วัดตามกฎ
-
กฎข้อที่สองของการแยกกระแสไฟฟ้าของฟาราเดย์: สำหรับปริมาณไฟฟ้าที่กำหนด (ประจุไฟฟ้า) มวลขององค์ประกอบทางเคมีที่สะสมบนอิเล็กโทรดจะเป็นสัดส่วนโดยตรงกับมวลที่เท่ากันขององค์ประกอบ มวลที่เท่ากันของสารคือมวลโมลาร์ของมันหารด้วยจำนวนเต็มขึ้นอยู่กับปฏิกิริยาทางเคมีที่สารนั้นมีส่วนเกี่ยวข้อง
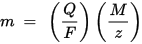
m คือมวลของสารที่สะสมในอิเล็กโทรด Q คือประจุไฟฟ้าทั้งหมดที่ผ่านสาร F = 96,485.33 (83) C โมล - 1 คือค่าคงที่ฟาราเดย์ M คือมวลโมเลกุลของสาร (ตัวอย่างเช่นมวลโมลาร์ของน้ำ H2O = 18 กรัม / mol), z คือจำนวนเวเลนซ์ของไอออนของสาร (จำนวนอิเล็กตรอนต่อไอออน)
โปรดทราบว่า M / z คือมวลเทียบเท่าของสารตกตะกอน สำหรับกฎของฟาราเดย์แรก M, F และ z เป็นค่าคงที่ดังนั้นค่าของ Q ที่มากขึ้นยิ่งค่าของ m มากขึ้น สำหรับกฎหมายฟาราเดย์ที่สอง Q, F และ z เป็นค่าคงที่ดังนั้นยิ่งค่า M / z (มวลเท่ากัน) ยิ่งมีค่ามากเท่าไรค่าของ m ก็ยิ่งมากขึ้นเท่านั้น
กระแสไฟฟ้าถูกนำมาใช้กันอย่างแพร่หลายในอุตสาหกรรมและเทคโนโลยี ยกตัวอย่างเช่นมันเป็นกระแสไฟฟ้าที่ทำหน้าที่เป็นหนึ่งในวิธีที่มีประสิทธิภาพมากที่สุดสำหรับการผลิตไฮโดรเจนไฮโดรเจนเปอร์ออกไซด์ออกไซด์ของแมงกานีสอลูมิเนียมโซเดียมแมกนีเซียมแมกนีเซียมแคลเซียมและสารอื่น ๆ กระแสไฟฟ้าถูกนำมาใช้ในการบำบัดน้ำเสียในการชุบในการชุบและในที่สุดในแหล่งเคมีปัจจุบัน แต่สิ่งแรกก่อน
การได้รับโลหะบริสุทธิ์จากแร่โดยการแยกด้วยกระแสไฟฟ้า
ด้วยกระแสไฟฟ้าทำให้โลหะจำนวนมากถูกสกัดจากแร่และถูกนำไปผ่านกระบวนการต่อไป ดังนั้นเมื่อแร่หรือแร่ธาตุเข้มข้น - เข้มข้น - ได้รับการบำบัดด้วยรีเอเจนต์โลหะจะผ่านเข้าไปในสารละลายและจากนั้นโดยการแยกด้วยไฟฟ้าโลหะจะถูกแยกออกจากสารละลาย โลหะบริสุทธิ์จะถูกปล่อยออกมาในเวลาเดียวกันที่แคโทด ด้วยวิธีนี้จะได้รับสังกะสีทองแดงแคดเมียม
โลหะจะถูกปรับด้วยไฟฟ้าเพื่อกำจัดสิ่งสกปรกและแปลงสิ่งสกปรกที่มีอยู่ให้อยู่ในรูปแบบที่สะดวกสำหรับการประมวลผลต่อไป โลหะที่จะทำความสะอาดนั้นจะถูกหล่อในรูปแบบของแผ่นเปลือกโลกและแผ่นเหล่านี้จะใช้เป็นขั้วบวกในอิเล็กโทรไลซิส
เมื่อกระแสไฟฟ้าผ่านไปโลหะของขั้วบวกจะละลายผ่านไปในรูปของไพเพอร์ลงในสารละลายจากนั้นประจุบวกจะถูกปล่อยออกที่แคโทดและทำให้เกิดการตกตะกอนของโลหะบริสุทธิ์ ความไม่บริสุทธิ์ของขั้วบวกจะไม่ละลาย - พวกมันจะตกตะกอนด้วยสารละลายแอโนดหรือผ่านเข้าไปในอิเล็กโทรไลต์ซึ่งจะถูกกำจัดออกอย่างต่อเนื่องหรือเป็นระยะ
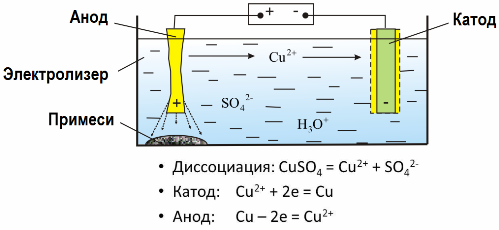
พิจารณาเป็นตัวอย่าง การชุบทองแดงด้วยไฟฟ้า. องค์ประกอบหลักของการแก้ปัญหา - คอปเปอร์ซัลเฟต - เกลือที่พบมากที่สุดและถูกที่สุดของโลหะนี้ วิธีการแก้ปัญหามีการนำไฟฟ้าต่ำ เพื่อเพิ่มกรดซัลฟิวริกจะถูกเพิ่มเข้าไปในอิเล็กโทรไลต์
นอกจากนี้ยังมีการเติมสารเติมแต่งในปริมาณเล็กน้อยเพื่อช่วยให้เกิดการตกตะกอนของโลหะที่มีขนาดกะทัดรัด โดยทั่วไปแล้วทองแดง, นิกเกิล, ตะกั่ว, ดีบุก, เงิน, และทองคำจะได้รับการกลั่นด้วยไฟฟ้า
การบำบัดน้ำเสียด้วยกระแสไฟฟ้า
กระแสไฟฟ้าถูกนำมาใช้ในการบำบัดน้ำเสีย (กระบวนการของการรวมตัวด้วยไฟฟ้า, การขยายด้วยไฟฟ้าและการแยกด้วยไฟฟ้า) วิธีการทำความสะอาดด้วยไฟฟ้าเคมีเป็นหนึ่งในวิธีที่นิยมใช้กันมากที่สุด สำหรับอิเล็กโทรไลซิสจะใช้ anodes ที่ไม่ละลายน้ำ (แมกไนต์, ตะกั่วออกไซด์, กราไฟต์, แมงกานีสซึ่งวางอยู่บนฐานไทเทเนียม) หรือใช้ (อลูมิเนียม, เหล็ก) ที่ละลายน้ำได้
วิธีนี้ใช้เพื่อแยกสารอินทรีย์และสารอนินทรีย์ที่เป็นพิษออกจากน้ำ ตัวอย่างเช่นท่อทองแดงจะถูกทำความสะอาดด้วยเครื่องชั่งด้วยสารละลายของกรดซัลฟิวริกและจากนั้นจะต้องทำความสะอาดน้ำเสียอุตสาหกรรมด้วยอิเล็กโทรไลซิสด้วยขั้วบวกที่ไม่ละลายน้ำ ทองแดงถูกปล่อยออกมาที่แคโทดซึ่งสามารถนำมาใช้อีกครั้งในองค์กรเดียวกัน
น้ำเสียจากอัลคาไลน์บริสุทธิ์ด้วยกระแสไฟฟ้าจากสารประกอบไซยาไนด์ เพื่อเร่งปฏิกิริยาออกซิเดชันของไซยาไนด์เพิ่มการนำไฟฟ้าและประหยัดพลังงานสารเติมแต่งในรูปแบบของโซเดียมคลอไรด์จะถูกใช้ในน้ำ
อิเล็กโทรไลซิสจะทำด้วยกราไฟต์แอโนดและแคโทดเหล็ก ไซยาไนด์จะถูกทำลายในระหว่างการเกิดออกซิเดชันทางเคมีไฟฟ้าและคลอรีนซึ่งปล่อยออกมาบนขั้วบวก ประสิทธิภาพของการทำความสะอาดนั้นใกล้เคียงกับ 100%
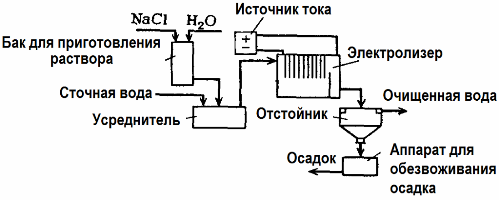
นอกจากการทำความสะอาดด้วยไฟฟ้าเคมีโดยตรงแล้วมันยังสามารถรวมอยู่ในกระบวนการอิเล็กโทรไลซิส การแข็งตัว. ไม่รวมการเติมเกลืออิเล็กโทรไลซิสจะดำเนินการด้วยอลูมิเนียมที่ละลายน้ำได้หรือเหล็กแอโนด จากนั้นไม่เพียง แต่สิ่งปนเปื้อนในขั้วบวกเท่านั้นที่จะถูกทำลาย แต่ตัวขั้วบวกก็จะสลายไป สารประกอบที่กระจายตัวแบบแอคทีฟจะเกิดขึ้นที่จับเป็นก้อน (ข้น) คอลลอยด์ปนเปื้อนที่กระจายตัว
วิธีนี้มีประสิทธิภาพในการบำบัดน้ำเสียจากไขมันผลิตภัณฑ์น้ำมันสีย้อมน้ำมันสารกัมมันตรังสี ฯลฯ เรียกว่าการทำปฏิกิริยาด้วยไฟฟ้า
ชุบสังกะสี
การชุบด้วยไฟฟ้าคือการสะสมด้วยไฟฟ้าของโลหะบางชนิดเพื่อปกป้องผลิตภัณฑ์จากการกัดกร่อนและเพื่อให้พวกเขามีลักษณะสวยงามที่เหมาะสม (เคลือบทำด้วยโครเมียม, นิกเกิล, เงิน, ทอง, ทองคำขาวและอื่น ๆ ) สิ่งที่ทำความสะอาดอย่างละเอียดลดลงและใช้เป็นแคโทดในอ่างไฟฟ้าที่สารละลายเกลือของโลหะที่มีความจำเป็นในการเคลือบผลิตภัณฑ์เท
ใช้โลหะแผ่นเดียวกันเป็นขั้วบวก ตามกฎแล้วจะใช้แผ่นขั้วบวกคู่และวัตถุที่ถูกชุบสังกะสีจะถูกวางไว้ระหว่างกัน
galvanoplastics
การชุบด้วยไฟฟ้า - การสะสมของโลหะบนพื้นผิวของวัตถุที่แตกต่างกันเพื่อสร้างรูปร่างของพวกเขา: แม่พิมพ์สำหรับชิ้นส่วนหล่อ, ประติมากรรม, cliches ที่พิมพ์ ฯลฯ

การชุบโลหะด้วยไฟฟ้าของ Galvanic บนพื้นผิวของวัตถุเป็นไปได้เฉพาะเมื่อพื้นผิวนี้หรือวัตถุทั้งหมดเป็นตัวนำกระแสไฟฟ้าดังนั้นจึงแนะนำให้ใช้โลหะเพื่อทำแบบจำลองหรือรูปแบบ โลหะที่หลอมได้มีความเหมาะสมที่สุดสำหรับวัตถุประสงค์นี้: ตะกั่วดีบุกทหารโลหะผสมไม้
โลหะเหล่านี้มีความอ่อนนุ่มประมวลผลได้ง่ายด้วยเครื่องมืองานโลหะมีการแกะสลักและหล่อ หลังจากที่สร้างชั้น Galvanic และตกแต่งเสร็จแล้วแม่พิมพ์โลหะจะถูกหลอมจากผลิตภัณฑ์สำเร็จรูป
อย่างไรก็ตามโอกาสที่ยิ่งใหญ่ที่สุดสำหรับการผลิตแบบจำลองยังคงแสดงโดยวัสดุอิเล็กทริก เมื่อต้องการทำให้แบบจำลองเป็นเช่นนั้นจำเป็นต้องให้ค่าการนำไฟฟ้าทางพื้นผิว ความสำเร็จหรือความล้มเหลวในที่สุดก็ขึ้นอยู่กับคุณภาพของชั้นสื่อกระแสไฟฟ้าเป็นหลัก เลเยอร์นี้สามารถใช้ได้หนึ่งในสามวิธี
วิธีที่พบมากที่สุดคือ grafitirovanieมันเหมาะสำหรับรูปแบบของน้ำมันและวัสดุอื่น ๆ ที่ช่วยให้การบดของกราไฟท์บนพื้นผิว
เคล็ดลับต่อไปคือ bronzingวิธีนี้ดีสำหรับรุ่นที่มีรูปร่างค่อนข้างซับซ้อนสำหรับวัสดุที่แตกต่างกันอย่างไรก็ตามเนื่องจากความหนาของชั้นทองแดงการถ่ายโอนชิ้นส่วนขนาดเล็กจะค่อนข้างบิดเบี้ยว
และในที่สุด สีเงินเหมาะสำหรับทุกกรณี แต่ที่ขาดไม่ได้สำหรับรุ่นที่เปราะบางที่มีรูปร่างที่ซับซ้อนมาก - พืชแมลง ฯลฯ
แหล่งเคมีในปัจจุบัน
นอกจากนี้อิเล็กโทรไลซิสยังเป็นกระบวนการหลักเนื่องจากเป็นแหล่งกระแสเคมีขั้นสูงสุดเช่นแบตเตอรี่และตัวสะสมฟังก์ชัน มีอิเล็กโทรดสองขั้วที่สัมผัสกับอิเล็กโทรไลต์
ความแตกต่างที่เป็นไปได้เกิดขึ้นระหว่างขั้วไฟฟ้า - แรงเคลื่อนไฟฟ้าที่สอดคล้องกับพลังงานอิสระของปฏิกิริยารีดอกซ์ ดูที่นี่สำหรับรายละเอียดเพิ่มเติม: แหล่งเคมีของกระแสไฟฟ้า
เลมอนแบตเตอรี่ (คลิกที่ภาพเพื่อขยาย)
การกระทำของแหล่งเคมีในปัจจุบันนั้นขึ้นอยู่กับการเกิดขึ้นของกระบวนการที่แยกออกจากกันด้วยการปิดวงจรภายนอก: บนขั้วบวกเชิงลบตัวรีดิวซ์จะถูกออกซิไดซ์อิเล็กตรอนอิสระที่เกิดขึ้นผ่านวงจรภายนอกไปยังขั้วลบเชิงบวก ดังนั้นการไหลของอิเล็กตรอนที่มีประจุลบไปตามวงจรภายนอกจะเริ่มจากขั้วบวกไปยังแคโทดนั่นคือจากขั้วลบไปยังขั้วบวก
ดูได้ที่ e.imadeself.com
: