Catégories: Articles en vedette » Électriciens débutants
Nombre de fois vus: 36288
Commentaires sur l'article: 1
Sources de courant chimique: principales caractéristiques
 Depuis plus de deux siècles, l'humanité utilise l'énergie des réactions chimiques entre diverses substances pour produire du courant continu.
Depuis plus de deux siècles, l'humanité utilise l'énergie des réactions chimiques entre diverses substances pour produire du courant continu.
Principe de fonctionnement
La réaction redox se produisant entre des substances ayant les propriétés d'un agent oxydant et d'un agent réducteur s'accompagne de la libération d'électrons, dont le mouvement forme un courant électrique. Cependant, pour utiliser son énergie, il est nécessaire de créer des conditions pour le passage des électrons à travers un circuit externe; sinon, il est libéré par la chaleur d'un simple mélange d'un agent oxydant et d'un agent réducteur.
Par conséquent, toutes les sources de courant chimique ont deux électrodes:
-
l'anode sur laquelle l'oxydation se produit;
-
cathode, effectuant la restauration de la substance.
Les électrodes à distance sont placées dans un récipient avec un électrolyte - une substance qui conduit le courant électrique en raison des processus de dissociation du milieu en ions.
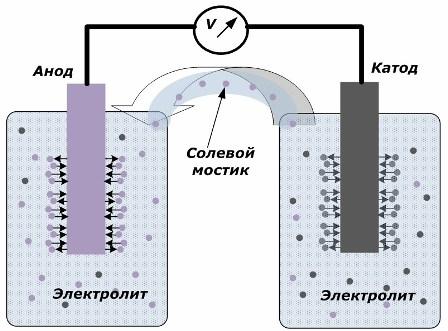
Le principe de la conversion de l'énergie chimique en énergie électrique
La figure montre que les électrodes sont placées dans des récipients séparés reliés par un pont de sel à travers lequel le mouvement des ions le long du circuit interne est créé. Lorsque les circuits externes et internes sont ouverts, deux processus se produisent sur les électrodes: la transition des ions du métal de l'électrode vers l'électrolyte et la transition des ions de l'électrolyte vers le réseau cristallin des électrodes.
Les débits de ces processus sont les mêmes et les potentiels de tension de signes opposés s'accumulent sur chaque électrode. S'ils sont connectés via un pont de sel et qu'une charge est appliquée, un circuit électrique se produit. Un courant interne est généré par le mouvement des ions entre les électrodes à travers l'électrolyte et le pont salin. Le mouvement des électrons le long du circuit externe dans la direction de l'anode à la cathode.
Presque toutes les réactions redox s'accompagnent d'une production d'électricité. Mais sa valeur dépend de nombreux facteurs, notamment les volumes et les masses des produits chimiques utilisés, les matériaux utilisés pour fabriquer les électrodes, tels que l'électrolyte, la concentration en ions, la conception.
Les plus couramment utilisées dans les sources de courant chimique modernes sont:
-
pour le matériau de l'anode (agent réducteur), le zinc (Zn), le plomb (Pb), le cadmium (Cd) et certains autres métaux;
-
pour le matériau de la cathode (oxydant) - oxyde de plomb PbO2, oxyde de manganèse MnO2, hydroxyde de nickel NiOOH et autres;
-
électrolytes à base de solutions d'acides, d'alcalis ou de sels.
Méthodes de classification
Une partie des sources d'énergie chimiques peut être réutilisée, tandis que l'autre ne le peut pas. Ce principe est pris comme base de leur classification.
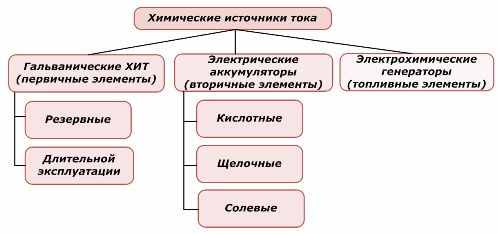
Classification des éléments chimiques
Force électromotrice cellules galvaniques, selon la conception, atteint 1,2 ÷ 1,5 volts. Pour obtenir de grandes valeurs, ils sont combinés en batteries, se connectant en série. Lorsque les batteries sont connectées en parallèle, le courant et la puissance augmentent.
Il est généralement admis que les sources primaires de courant chimique ne supportent pas la recharge, bien que plus précisément cette position puisse être formulée différemment: sa mise en œuvre n'est pas économiquement faisable.
Les sources de courant chimique primaire redondantes sont stockées dans un état où l'électrolyte est isolé des électrodes. Cela élimine l'occurrence de la réaction redox et assure la préparation pour la mise en service. Ils ne sont pas réutilisés. La durée de conservation des sources d'alimentation de secours chimiques est limitée à 10 à 15 ans.
Les batteries sont rechargées avec succès par l'application d'énergie électrique externe. En raison de cette fonctionnalité, elles sont appelées sources de courant secondaires. Ils sont capables de supporter des centaines et des milliers de cycles de charge-décharge.L'EMF de la batterie peut être de l'ordre de 1,0 ÷ 1,5 volts. Ils sont également combinés en batteries.
Les générateurs électrochimiques fonctionnent sur le principe des cellules galvaniques, mais ils transportent des substances de l'extérieur pour effectuer une réaction électrochimique, et tous les produits libérés sont retirés de l'électrolyte. Cela vous permet d'organiser un processus continu.
Caractéristiques de performance clés des sources d'énergie chimiques
1. La tension aux bornes ouvertes
Selon la conception, une seule source ne peut créer qu'une certaine différence de potentiel. Pour une utilisation dans des appareils électriques, ils sont combinés en batteries.
2. Capacité spécifique
Pendant un certain temps (en heures), une source de courant chimique peut générer une quantité limitée de courant (en ampères), qui est attribuée à une unité de poids ou de volume.
3. Densité de puissance
Il caractérise la capacité d'une unité de poids ou de volume d'une source de courant chimique à générer de l'énergie générée par le produit de la tension par l'intensité du courant.
4. Durée de l'opération
Ce paramètre est également appelé date d'expiration.
5. La valeur des courants d'autodécharge
Ces processus secondaires de réactions électrochimiques conduisent à la consommation de la masse active des éléments, provoquent de la corrosion et réduisent la capacité spécifique.
6. Prix du produit
Dépend de la conception, des matériaux utilisés et d'un certain nombre d'autres facteurs.
Les meilleures sources de courant chimique sont celles qui ont des valeurs élevées des quatre premiers paramètres, et l'autodécharge et le coût sont faibles.
Principes de charge de la batterie
Parmi les sources de courant chimique secondaire, elles gagnent en popularité. modèles lithium-ion, qui sont devenus largement utilisés pour alimenter les appareils électroniques. Ils utilisent LiMO2 (M Co, Ni, Mn) comme matériau de l'électrode positive et du graphite comme négatif.
Une fois chargés, les ions lithium de l'énergie externe appliquée sont libérés du métal de la cathode, traversent l'électrolyte et pénètrent dans l'espace entre les couches de graphite, s'y accumulant.
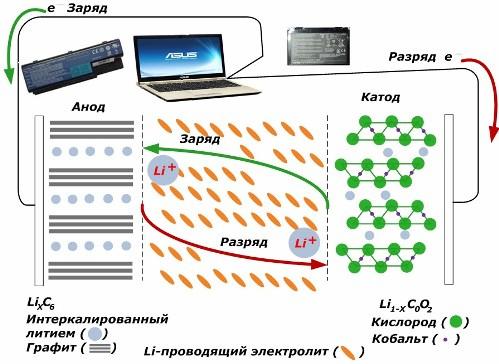
Quand l'énergie chargeur est absent, et la charge est connectée aux électrodes, puis les ions lithium dans l'électrolyte se déplacent dans la direction opposée.
Si la charge et la décharge ne sont pas effectuées, l'énergie dans la batterie n'est pas consommée, mais stockée. Mais sa quantité est limitée par les propriétés des matériaux utilisés. Par exemple, dans les batteries lithium-ion, la capacité électrique spécifique est de 130 ÷ 150 mAh / g. Elle est limitée par les propriétés du matériau anodique. Pour le graphite, la capacité est environ deux fois plus élevée.
Les scientifiques recherchent actuellement des moyens d'augmenter la capacité de la batterie et étudient la possibilité d'utiliser une réaction chimique entre le lithium et l'oxygène dans l'air. Pour ce faire, des conceptions sont développées avec une cathode à air non consommable, utilisée dans des batteries séparées. Cette méthode peut augmenter la densité d'énergie jusqu'à 10 fois.
Le fonctionnement des sources de courant chimique nécessite des connaissances principes de base du génie électrique, électrochimie, science des matériaux et physique du solide.
Voir aussi sur e.imadeself.com
:
