Catégories: Électriciens débutants, Électricien industriel
Nombre de fois vus: 37528
Commentaires sur l'article: 0
L'application pratique de l'électrolyse
Lorsqu'un courant électrique passe à travers une solution ou une fusion d'un électrolyte, des électrodes dissoutes ou d'autres substances qui sont le produit de réactions secondaires sur les électrodes sont libérées sur les électrodes. Ce processus physico-chimique est appelé électrolyse.
L'essence de l'électrolyse
Dans le champ électrique créé par les électrodes, les ions dans le fluide conducteur viennent dans un mouvement ordonné. L'électrode négative est la cathode, le positif est l'anode.
Les ions négatifs appelés anions (ions du groupe hydroxyle et résidus acides) se précipitent vers l'anode, et les ions positifs appelés cations (hydrogène, métal, ions ammonium, etc.) se précipitent vers la cathode
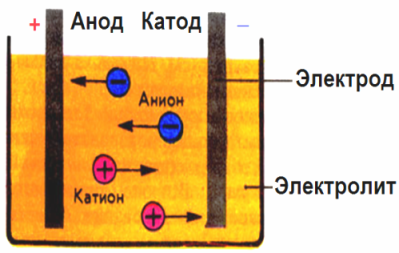
Un processus d'oxydoréduction a lieu aux électrodes: la réduction électrochimique des particules (atomes, molécules, cations) se produit à la cathode, et l'oxydation électrochimique des particules (atomes, molécules, anions) se produit à l'anode. Les réactions de dissociation dans un électrolyte sont des réactions primaires, et les réactions qui se produisent directement aux électrodes sont appelées secondaires.
Les lois de l'électrolyse de Faraday
La séparation des réactions d'électrolyse en primaire et secondaire a aidé Michael Faraday à établir les lois de l'électrolyse:
-
Première loi de l'électrolyse de Faraday: la masse de la substance déposée sur l'électrode lors de l'électrolyse est directement proportionnelle à la quantité d'électricité transférée à cette électrode. Par quantité d'électricité, on entend une charge électrique, mesurée, en règle générale, en pendentifs.
-
Deuxième loi de l'électrolyse de Faraday: pour une quantité d'électricité donnée (charge électrique), la masse d'un élément chimique déposée sur l'électrode est directement proportionnelle à la masse équivalente de l'élément. La masse équivalente d'une substance est sa masse molaire divisée par un nombre entier, selon la réaction chimique dans laquelle la substance est impliquée.
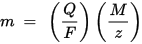
m est la masse de la substance déposée sur l'électrode, Q est la charge électrique totale traversant la substance F = 96 485,33 (83) C mol - 1 est la constante de Faraday, M est la masse molaire de la substance (par exemple, la masse molaire de l'eau H2O = 18 g / mol), z est le nombre de valence des ions d'une substance (le nombre d'électrons par ion).
Notez que M / z est la masse équivalente de la substance précipitée. Pour la première loi de Faraday, M, F et z sont des constantes, donc plus la valeur de Q est grande, plus la valeur de m est grande. Pour la deuxième loi de Faraday, Q, F et z sont des constantes, donc plus la valeur de M / z (masse équivalente) est grande, plus la valeur de m est grande.
L'électrolyse est aujourd'hui largement utilisée dans l'industrie et la technologie. Par exemple, c'est l'électrolyse qui constitue l'une des méthodes les plus efficaces pour la production industrielle d'hydrogène, de peroxyde d'hydrogène, de dioxyde de manganèse, d'aluminium, de sodium, de magnésium, de calcium et d'autres substances. L'électrolyse est utilisée pour traiter les eaux usées, en galvanoplastie, en galvanoplastie et enfin dans les sources de courant chimique. Mais tout d'abord.
Obtention de métaux purs à partir de minerais par électrolyse
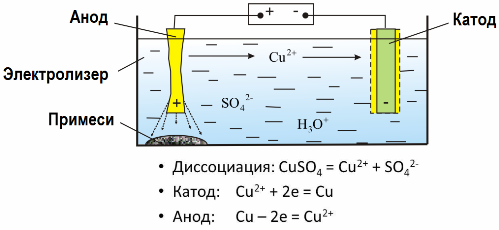
Grâce à l'électrolyse, de nombreux métaux sont extraits des minerais et soumis à un traitement ultérieur. Ainsi, lorsque du minerai ou du minerai enrichi - concentré - est traité avec des réactifs, le métal passe dans la solution, puis, par électroextraction, le métal est isolé de la solution. Du métal pur est libéré en même temps au niveau de la cathode. De cette façon, recevez du zinc, du cuivre, du cadmium.
Les métaux sont soumis à un affinage électrolytique pour éliminer les impuretés et pour convertir les impuretés contenues en une forme appropriée pour un traitement ultérieur. Le métal à nettoyer est coulé sous forme de plaques, et ces plaques sont utilisées comme anodes en électrolyse.
Lorsque le courant passe, le métal de l'anode se dissout, passe sous forme de cations dans la solution, puis les cations sont évacués à la cathode et forment un précipité de métal pur. Les impuretés de l'anode ne se dissolvent pas - elles précipitent avec la suspension d'anode, ou passent dans l'électrolyte, d'où elles sont éliminées en continu ou périodiquement.
Considérez comme exemple électroraffinage du cuivre. Le principal composant de la solution - le sulfate de cuivre - le sel le plus commun et le moins cher de ce métal. La solution a une faible conductivité électrique. Pour l'augmenter, de l'acide sulfurique est ajouté à l'électrolyte.
De plus, de petites quantités d'additifs sont introduites dans la solution pour faciliter la formation d'un précipité métallique compact. En général, le cuivre, le nickel, le plomb, l'étain, l'argent et l'or sont soumis à un raffinage électrolytique.
Traitement des eaux usées par électrolyse
L'électrolyse est utilisée dans le traitement des eaux usées (processus d'électrocoagulation, d'électroextraction et d'électroflottation). La méthode de nettoyage électrochimique est l'une des plus utilisées. Pour l'électrolyse, des anodes insolubles (magnétite, oxyde de plomb, graphite, manganèse, qui sont déposées sur une base en titane), ou solubles (aluminium, fer) sont utilisées.
Cette méthode est utilisée pour isoler les substances organiques et inorganiques toxiques de l'eau. Par exemple, les tuyaux en cuivre sont nettoyés du tartre avec une solution d'acide sulfurique, et les eaux usées industrielles doivent ensuite être nettoyées par électrolyse avec une anode insoluble. Le cuivre est libéré à la cathode, qui peut à nouveau être utilisé dans la même entreprise.
Les eaux usées alcalines sont purifiées par électrolyse à partir de composés cyanurés. Afin d'accélérer l'oxydation des cyanures, d'augmenter la conductivité électrique et d'économiser de l'énergie, un additif sous forme de chlorure de sodium est utilisé dans l'eau.
L'électrolyse est réalisée avec une anode en graphite et une cathode en acier. Les cyanures sont détruits lors de l'oxydation électrochimique et du chlore, qui est libéré sur l'anode. L'efficacité d'un tel nettoyage est proche de 100%.
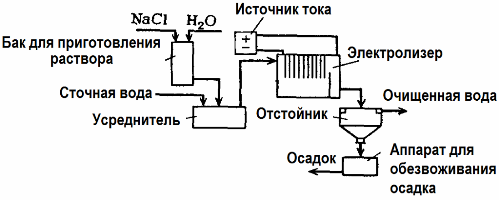
En plus du nettoyage électrochimique direct, il peut être inclus dans le processus d'électrolyse coagulation. Hors ajout de sels, l'électrolyse est réalisée avec des anodes solubles en aluminium ou en fer. Ensuite, non seulement les contaminants sur l'anode sont détruits, mais l'anode elle-même se dissout. Il se forme des composés dispersés actifs qui coagulent (épaississent) les contaminants colloïdaux dispersés.
Cette méthode est efficace pour traiter les eaux usées des graisses, des produits pétroliers, des colorants, des huiles, des substances radioactives, etc. Elle est appelée électrocoagulation.
Galvanoplastie
La galvanoplastie est le dépôt électrolytique de certains métaux afin de protéger les produits de la corrosion et de leur donner un aspect esthétique approprié (le revêtement est réalisé en chrome, nickel, argent, or, platine, etc.). La chose est soigneusement nettoyée, dégraissée et utilisée comme cathode dans un bain électrolytique dans lequel une solution saline du métal avec laquelle il est nécessaire de recouvrir le produit est versée.
Une plaque du même métal est utilisée comme anode. En règle générale, une paire de plaques d'anode est utilisée et le sujet à galvaniser est placé entre elles.
Électroformage
Galvanoplastie - dépôt de métal à la surface de différents corps pour reproduire leurs formes: moules pour mouler des pièces, sculptures, clichés imprimés, etc.

Le dépôt galvanique de métal sur la surface d'un objet n'est possible que lorsque cette surface ou l'objet entier est un conducteur de courant électrique, il est donc souhaitable d'utiliser des métaux pour réaliser des modèles ou des formes. Les métaux fusibles conviennent le mieux à cette fin: plomb, étain, soudures, alliage de bois.
Ces métaux sont doux, faciles à traiter avec des outils de ferronnerie, sont bien gravés et coulés. Après la constitution de la couche galvanique et la finition, le métal du moule est fondu à partir du produit fini.
Cependant, les plus grandes opportunités pour la fabrication de modèles sont toujours représentées par les matériaux diélectriques. Pour métalliser de tels modèles, il est nécessaire de donner leur conductivité électrique de surface. Le succès ou l'échec dépend finalement de la qualité de la couche conductrice. Cette couche peut être appliquée de trois manières.
Le moyen le plus courant est graphitisation, il convient aux modèles de pâte à modeler et autres matériaux qui permettent le broyage du graphite en surface.
L'astuce suivante est bronzage, la méthode est bonne pour les modèles de forme relativement complexe, pour différents matériaux, cependant, en raison de l'épaisseur de la couche de bronze, le transfert de petits détails est quelque peu déformé.
Et enfin argentureadapté dans tous les cas, mais surtout indispensable pour les modèles fragiles de forme très complexe - plantes, insectes, etc.
Sources de courant chimique
De plus, l'électrolyse est le principal processus grâce auquel les sources de courant chimique les plus avancées, telles que les piles et les accumulateurs, fonctionnent. Il y a deux électrodes en contact avec l'électrolyte.
Une différence de potentiel est établie entre les électrodes - une force électromotrice correspondant à l'énergie libre de la réaction redox. Voir ici pour plus de détails: Sources chimiques de courant électrique
Batterie au citron (cliquez sur l'image pour agrandir)
L'action des sources de courant chimique est basée sur la survenue de processus séparés spatialement avec un circuit externe fermé: sur l'anode négative, l'agent réducteur est oxydé, les électrons libres qui se forment passent à travers le circuit externe vers la cathode positive, créant un courant de décharge, où ils participent à la réaction de réduction d'oxydation. Ainsi, le flux d'électrons chargés négativement le long du circuit externe va de l'anode à la cathode, c'est-à-dire de l'électrode négative à l'électrode positive.
Voir aussi sur e.imadeself.com
: