Catégories: Articles en vedette » Électriciens débutants
Nombre de fois vus: 70526
Commentaires sur l'article: 0
Cellules galvaniques - appareil, principe de fonctionnement, types et principales caractéristiques
Conditions préalables à l'apparition de cellules galvaniques. Un peu d'histoire. En 1786, le professeur de médecine italien, le physiologiste Luigi Aloisio Galvani découvrit un phénomène intéressant: les muscles des pattes postérieures d'un cadavre de grenouille fraîchement ouvert suspendu à des crochets de cuivre se contractèrent lorsque le scientifique les toucha avec un scalpel en acier. Galvani a immédiatement conclu qu'il s'agissait d'une manifestation de «l'électricité animale».
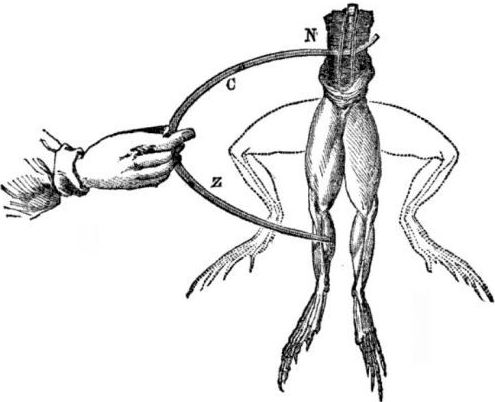
Après la mort de Galvani, son contemporain Alessandro Volta, en tant que chimiste et physicien, décrira et démontrera publiquement un mécanisme plus réaliste pour l'apparition de courant électrique lorsque différents métaux entrent en contact.
Volta, après une série d'expériences, arrivera à la conclusion sans équivoque que le courant apparaît dans le circuit en raison de la présence en son sein de deux conducteurs de métaux différents placés dans un liquide, et ce n'est pas du tout de «l'électricité animale», comme le pensait Galvani. La contraction des cuisses de la grenouille était une conséquence de l'action du courant provenant du contact de divers métaux (crochets de cuivre et scalpel en acier).
Volta montrera les mêmes phénomènes que Galvani a montré sur une grenouille morte, mais sur un électromètre fait maison complètement inanimé, et en 1800 donnera une explication précise du courant: «le conducteur de seconde classe (liquide) est au milieu et est en contact avec deux conducteurs de première classe de deux conducteurs différents les métaux ... À la suite de cela, un courant électrique d'une direction ou d'une autre se produit. »

Dans l'une des premières expériences, Volta a abaissé deux plaques - zinc et cuivre - dans un pot d'acide et les a connectées avec du fil. Après cela, la plaque de zinc a commencé à se dissoudre et des bulles de gaz se sont formées sur l'acier de cuivre. Volta a suggéré et prouvé que le courant électrique traverse le fil.
Ainsi a été inventé "l'élément Volta" - la première cellule galvanique. Pour plus de commodité, Volta lui a donné la forme d'un cylindre vertical (pilier), composé d'anneaux interconnectés de zinc, de cuivre et de tissu imprégné d'acide. Un pôle volt d'un demi-mètre de haut a créé une tension sensible aux humains.
Depuis le début de la recherche a été posée par Luigi Galvani, le nom source de courant chimique conservé la mémoire de lui en son nom.
Cellule galvanique Est une source chimique de courant électrique, basée sur l'interaction de deux métaux et / ou de leurs oxydes dans un électrolyte, conduisant à l'apparition d'un courant électrique en circuit fermé. Ainsi, dans les cellules galvaniques, l'énergie chimique est convertie en énergie électrique.
Cellules aujourd'hui

Les cellules sont aujourd'hui appelées batteries. Trois types de piles sont répandues: salines (sèches), alcalines (elles sont également appelées alcalines, "alcalines" en anglais - "alcalines") et au lithium. Le principe de leur travail est le même que celui décrit par Volta en 1800: deux métaux interagir par électrolyte, et un courant électrique apparaît dans un circuit fermé externe.
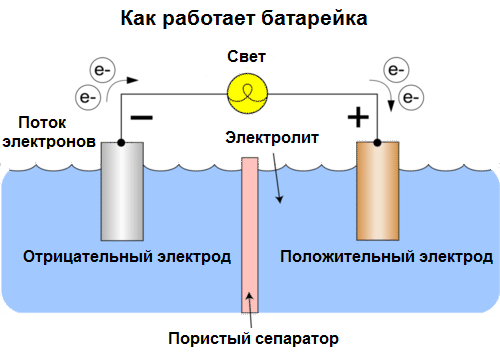
La tension de la batterie dépend des métaux utilisés et du nombre de cellules dans la "batterie". Les batteries, contrairement aux batteries, ne sont pas capables de restaurer leurs propriétés, car elles convertissent directement l'énergie chimique, c'est-à-dire l'énergie des réactifs (réducteur et oxydant) qui composent la batterie, en énergie électrique.
Les réactifs inclus dans la batterie sont consommés pendant son fonctionnement, le courant diminue progressivement, par conséquent, l'action de la source s'arrête après que les réactifs ont complètement réagi.
Les éléments alcalins et salins (piles) sont largement utilisés pour alimenter une variété d'appareils électroniques, d'équipements radio, de jouets et le lithium se trouve le plus souvent dans les appareils médicaux portables tels que les lecteurs de glycémie ou dans la technologie numérique comme les appareils photo.

Piles au sel
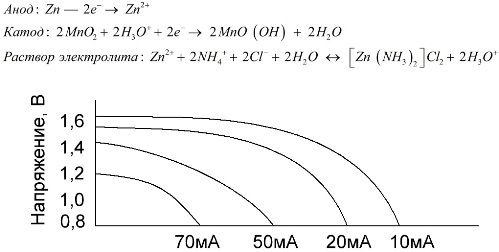
Les piles au manganèse-zinc, appelées piles au sel, sont des piles galvaniques «sèches», à l'intérieur desquelles il n'y a pas de solution d'électrolyte liquide.
Une électrode en zinc (+) est une cathode en forme de coupe, et un mélange pulvérulent de dioxyde de manganèse et de graphite sert d'anode. Le courant passe à travers une tige de graphite. En tant qu'électrolyte, une pâte est utilisée à partir d'une solution de chlorure d'ammonium avec l'ajout d'amidon ou de farine pour épaissir, de sorte que rien ne coule.
En règle générale, les fabricants de batteries n'indiquent pas la composition exacte des éléments salins.Cependant, les batteries au sel sont les moins chères, elles sont généralement utilisées dans des appareils où la consommation d'énergie est extrêmement faible: en heures, en télécommandes, en thermomètres électroniques, etc.

Le concept de "capacité nominale" est rarement utilisé pour caractériser les batteries au manganèse-zinc, car leur capacité dépend fortement des conditions de fonctionnement et des conditions. Les principaux inconvénients de ces éléments sont un taux significatif de réduction de tension tout au long de la décharge et une diminution significative de la capacité de sortie avec l'augmentation du courant de décharge. La tension de décharge finale est réglée en fonction de la charge dans la plage de 0,7 à 1,0 V.
Il est important non seulement l'ampleur du courant de décharge, mais également le calendrier de la charge. Avec des décharges intermittentes de courants importants et moyens, les performances des batteries augmentent sensiblement par rapport au fonctionnement continu. Cependant, avec de faibles courants de décharge et des mois d'interruptions de fonctionnement, leur capacité peut diminuer en raison de l'autodécharge.
Le graphique ci-dessus montre les courbes de décharge d'une batterie au sel moyenne pendant 4, 10, 20 et 40 heures pour une comparaison avec une batterie alcaline, qui sera discutée plus tard.
Piles alcalines (alcalines)
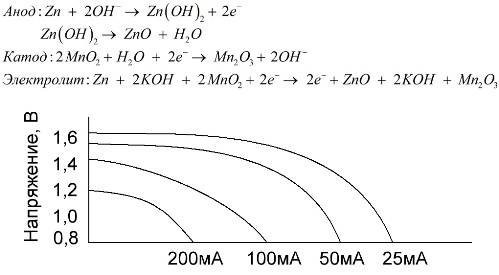
Une batterie alcaline est une batterie galvanique au manganèse-zinc, dans laquelle le dioxyde de manganèse est utilisé comme cathode, le zinc en poudre est utilisé comme anode et une solution alcaline est utilisée comme électrolyte, généralement sous la forme d'une pâte d'hydroxyde de potassium.
Ces batteries présentent un certain nombre d'avantages (en particulier, une capacité nettement supérieure, de meilleures performances à basses températures et des courants de charge élevés).

Les piles alcalines, par rapport aux piles au sel, peuvent fournir plus de courant pendant longtemps. Un courant plus important devient possible car le zinc est utilisé ici non pas sous forme de verre, mais sous forme de poudre ayant une plus grande surface de contact avec l'électrolyte. L'hydroxyde de potassium sous forme de pâte est utilisé comme électrolyte.
C'est grâce à la capacité de ce type de cellules galvaniques à délivrer un courant important (jusqu'à 1 A) pendant longtemps, les piles alcalines sont les plus courantes à l'heure actuelle.
Dans les jouets électriques, dans les équipements médicaux portables, dans les appareils électroniques, dans les appareils photo, les piles alcalines sont utilisées partout. Ils servent 1,5 fois plus longtemps que la solution saline si la décharge est à faible courant. Le graphique montre les courbes de décharge à différents courants pour comparaison avec une batterie au sel (le graphique a été donné ci-dessus) pendant 4, 10, 20 et 40 heures.
Piles au lithium
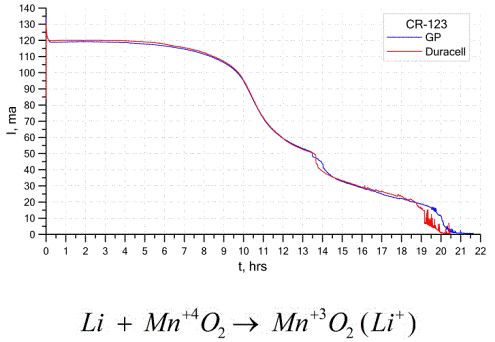
Les piles au lithium sont un autre type assez courant de piles galvaniques - des piles galvaniques non rechargeables uniques dans lesquelles le lithium ou ses composés sont utilisés comme anode. En raison de l'utilisation de métaux alcalins, ils ont une différence de potentiel élevée.

La cathode et l'électrolyte d'une pile au lithium pouvant être très différents, le terme «pile au lithium» combine donc un groupe de piles avec le même matériau d'anode.En tant que cathode, par exemple, le dioxyde de manganèse, le monofluorure de carbone, la pyrite, le chlorure de thionyle, etc. peuvent être utilisés.
Les batteries au lithium se distinguent des autres batteries par leur autonomie élevée et leur coût élevé. Selon la taille sélectionnée et les matériaux chimiques utilisés, une batterie au lithium peut produire des tensions de 1,5 V (compatible avec les piles alcalines) à 3,7 V.
Ces batteries ont la plus grande capacité par unité de masse et une longue durée de vie. Les piles au lithium sont largement utilisées dans les équipements électroniques portables modernes: pour alimenter les montres sur les cartes mères d'ordinateurs, pour alimenter les appareils médicaux portables, les montres, les calculatrices, les équipements photographiques, etc.
Le graphique ci-dessus montre les courbes de décharge de deux batteries au lithium de deux fabricants populaires. Le courant initial était de 120 mA (par résistance de l'ordre de 24 Ohms).
Voir aussi: Piles rechargeables modernes - avantages et inconvénients
Voir aussi sur e.imadeself.com
: