категории: Новаци електротехници, Индустриален електротехник
Брой преглеждания: 37528
Коментари към статията: 0
Практическото приложение на електролизата
Когато електрически ток преминава през разтвор или стопилка на електролит, разтворите или други вещества, които са продукти на вторични реакции върху електродите, се отделят върху електродите. Този физикохимичен процес се нарича електролиза.
Същността на електролизата
В електрическото поле, създадено от електродите, йоните в проводящата течност влизат в подредено движение. Отрицателният електрод е катода, положителният е анодът.
Отрицателните йони, наречени аниони (йони на хидроксилната група и киселинни остатъци) се втурват към анода, а положителните йони, наречени катиони (водород, метал, амониеви йони и др.), Се втурват към катода
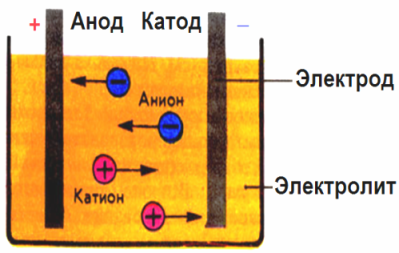
Окислително-редукционен процес протича при електродите: на катода се случва електрохимично редуциране на частици (атоми, молекули, катиони), а на анода се извършва електрохимично окисляване на частици (атоми, молекули, аниони). Реакциите на дисоциация в електролит са първични реакции, а реакциите, които протичат директно при електродите, се наричат вторични.
Законите на електролизата на Фарадей
Разделянето на реакциите на електролиза на първични и вторични помогна на Майкъл Фарадей да установи законите на електролизата:
-
Първият закон на електролизата на Фарадей: масата на веществото, отложено върху електрода по време на електролиза, е пряко пропорционално на количеството електричество, прехвърлено на този електрод. Под количество електричество се разбира електрически заряд, измерван по правило в висулки.
-
Вторият закон на електролизата на Фарадей: за дадено количество електроенергия (електрически заряд), масата на химически елемент, депозиран върху електрода, е пряко пропорционална на еквивалентната маса на елемента. Еквивалентната маса на веществото е неговата моларна маса, разделена на цяло число, в зависимост от химическата реакция, в която веществото участва.
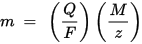
m е масата на веществото, отложено върху електрода, Q е общият електрически заряд, преминаващ през веществото F = 96,485.33 (83) C mol - 1 е константата на Фарадей, M е моларната маса на веществото (Например, моларната маса на водата H2O = 18 g / mol), z е валентният брой на йони на веществото (броят на електроните на йон).
Обърнете внимание, че M / z е еквивалентната маса на утаеното вещество. За първия закон на Фарадей M, F и z са константи, така че колкото по-голяма е стойността на Q, толкова по-голяма е стойността на m. За втория закон на Фарадей Q, F и z са константи, така че колкото по-голяма е стойността на M / z (еквивалентна маса), толкова по-голяма е стойността на m.
Електролизата се използва широко днес в промишлеността и в технологиите. Например, електролизата е един от най-ефективните методи за промишлено производство на водород, водороден пероксид, манганов диоксид, алуминий, натрий, магнезий, калций и други вещества. Електролизата се използва за пречистване на отпадъчни води, при галванопластика, галванопластика и накрая в източници на ток на химикали. Но първо първо.
Получаване на чисти метали от руди чрез електролиза
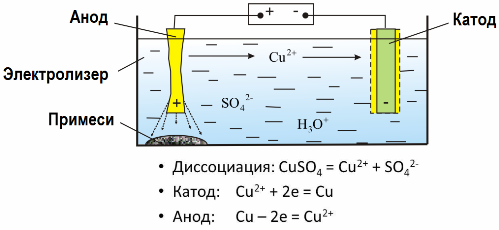
Благодарение на електролизата много метали се извличат от руди и се подлагат на по-нататъшна обработка. И така, когато руда или обогатена руда - концентрат - се обработва с реагенти, металът преминава в разтвора и след това чрез електроекстракция металът се изолира от разтвора. Чистият метал се освобождава едновременно на катода. По този начин получавайте цинк, мед, кадмий.
Металите се подлагат на електропречистване, за да се елиминират примесите и да се превърнат съдържащите се примеси във форма, удобна за по-нататъшна обработка. Металът, който трябва да се почисти, се отлива под формата на плочи и тези плочи се използват като аноди при електролиза.
Когато токът премине, металът на анода се разтваря, преминава под формата на катиони в разтвора, тогава катионите се отделят при катода и образуват утайка от чист метал. Онечистванията на анода не се разтварят - те се утаяват с анодната суспензия или преминават в електролита, откъдето се отстраняват непрекъснато или периодично.
Разгледайте като пример медно електроочистване, Основният компонент на разтвора - меден сулфат - най-разпространената и най-евтината сол на този метал. Разтворът има ниска електрическа проводимост. За да го увеличите, към електролита се добавя сярна киселина.
Освен това в разтвора се въвеждат малки количества добавки, за да се улесни образуването на компактна метална утайка. Като цяло, мед, никел, олово, калай, сребро и злато се подлагат на електролитично рафиниране.
Електролиза Пречистване на отпадни води
Електролизата се използва при пречистване на отпадни води (процеси на електрокоагулация, електроекстракция и електрофлотация). Методът на електрохимично почистване е един от най-често използваните. За електролиза се използват неразтворими аноди (магнетит, оловен оксид, графит, манган, които се отлагат върху титанова основа) или разтворими (алуминий, желязо).
Този метод се използва за изолиране на токсични органични и неорганични вещества от вода. Например, медните тръби се почистват от котлен камък с разтвор на сярна киселина, а промишлените отпадни води след това трябва да бъдат почистени чрез електролиза с неразтворим анод. Медът се освобождава на катода, който отново може да се използва в същото предприятие.
Алкалните отпадни води се пречистват чрез електролиза от цианидни съединения. За да се ускори окисляването на цианидите, да се увеличи електрическата проводимост и да се спести енергия, във водата се използва добавка под формата на натриев хлорид.
Електролизата се извършва с графитен анод и стоманен катод. Цианидите се разрушават при електрохимично окисляване и хлор, който се отделя на анода. Ефективността на такова почистване е близо 100%.
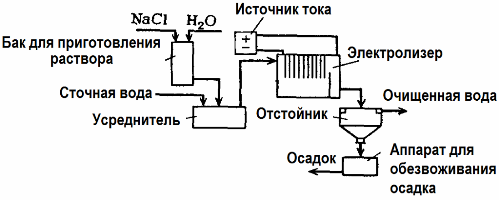
Освен директно електрохимично почистване, той може да бъде включен в процеса на електролиза коагулация, С изключение на добавянето на соли, електролизата се извършва с разтворим алуминиев или железен анод. Тогава не само замърсителите върху анода се унищожават, но и самият анод се разтваря. Образуват се активно диспергирани съединения, които коагулират (сгъстяват) колоидните диспергирани замърсители.
Този метод е ефективен при пречистване на отпадни води от мазнини, нефтопродукти, багрила, масла, радиоактивни вещества и др. Нарича се електрокоагулация.
поцинковане
Електроплакирането е електролитичното отлагане на определени метали, за да се предпазят продуктите от корозия и да им се придаде подходящ естетичен вид (покритието е с хром, никел, сребро, злато, платина и др.). Нещото се почиства старателно, обезмаслява и се използва като катод в електролитична вана, в която се излива солен разтвор на метала, с който е необходимо да се покрие продуктът.
Използва се плоча от същия метал като анода. Като правило се използва чифт анодни плочи и предметът, който ще бъде поцинкован, се поставя между тях.
galvanoplastics
Електроплакиране - отлагането на метал върху повърхността на различни тела за възпроизвеждане на техните форми: форми за леене на части, скулптури, печатни клишета и др.

Отлагането на галваничен метал върху повърхността на обект е възможно само когато тази повърхност или целият обект е проводник на електрически ток, така че е препоръчително да се използват метали за изработка на модели или форми. Подплавките метали са най-подходящи за тази цел: олово, калай, припои, Дървена сплав.
Тези метали са меки, лесно се обработват с инструменти за метални изделия, добре се гравират и отливат. След изграждането на галваничния слой и довършването, металовият метал се разтопява от готовия продукт.
Въпреки това, най-големите възможности за производство на модели все още са представени от диелектрични материали. За да се метализират такива модели, е необходимо да се даде на тяхната повърхностна електрическа проводимост. Успехът или неуспехът в крайна сметка зависи главно от качеството на проводимия слой. Този слой може да бъде нанесен по един от трите начина.
Най-често срещаният начин е grafitirovanie, той е подходящ за модели от пластилин и други материали, които позволяват шлайфане на графит по повърхността.
Следващият трик е бронзиращи, методът е добър за модели със сравнително сложна форма, за различни материали, обаче, поради дебелината на бронзовия слой, пренасянето на малки части е някак изкривено.
И накрая осребряванеподходящ във всички случаи, но особено незаменим за крехките модели с много сложна форма - растения, насекоми и др.
Химически източници на ток
Също така електролизата е основният процес, поради който функционират най-модерните химически източници на ток, като батерии и акумулатори. В контакт с електролита има два електрода.
Установява се потенциална разлика между електродите - електромоторна сила, съответстваща на свободната енергия на редукционната реакция. Вижте тук за повече подробности: Химически източници на електрически ток
Лимонова батерия (щракнете върху снимката, за да я увеличите)
Действието на източниците на химически ток се основава на възникване на пространствено разделени процеси със затворена външна верига: върху отрицателния анод редуциращият агент се окислява, свободните електрони, които се образуват преминават през външната верига към положителния катод, създавайки разряден ток, където участват в реакцията на намаляване на окислението. Така потокът от отрицателно заредени електрони по външната верига преминава от анода към катода, тоест от отрицателния електрод към положителния.
Вижте също на e.imadeself.com
: