Kategorijas: Piedāvātie raksti » Iesācēju elektriķi
Skatījumu skaits: 70526
Komentāri par rakstu: 0
Galvaniskās šūnas - ierīce, darbības princips, veidi un galvenie raksturlielumi
Galvanisko elementu parādīšanās priekšnoteikumi. Nedaudz vēstures. 1786. gadā itāļu medicīnas profesors, fiziologs Luigi Aloisio Galvani atklāja interesantu parādību: svaigi atvērtā vardes līkuma, kas piekarināts uz vara āķiem, pakaļkāju muskuļi saraujas, kad zinātnieks tiem pieskārās ar tērauda skalpeli. Galvani nekavējoties secināja, ka tā ir "dzīvnieku elektrības" izpausme.
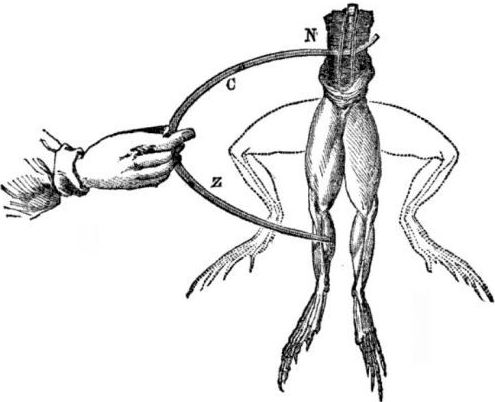
Pēc Galvani nāves viņa mūsdienu Alessandro Volta kā ķīmiķis un fiziķis aprakstīs un publiski parādīs reālistiskāku elektriskās strāvas rašanās mehānismu, kad nonāk saskarē dažādi metāli.
Pēc eksperimentu sērijas Volta nonāks pie nepārprotamiem secinājumiem, ka strāva ķēdē parādās tāpēc, ka tajā ir divi šķidrumā ievietoti dažādu metālu vadītāji, un tā nepavisam nav “dzīvnieka elektrība”, kā domāja Galvani. Vardes kāju raustīšanās bija strāvas darbības sekas, kas rodas dažādu metālu (vara āķi un tērauda skalpelis) kontakta rezultātā.
Volta parādīs tās pašas parādības, ko Galvani parādīja uz mirušas vardes, bet uz pilnīgi nedzīvu mājās gatavotu elektrometru, un 1800. gadā sniegs precīzu strāvas skaidrojumu: “otrās klases diriģents (šķidrums) atrodas vidū un ir kontaktā ar diviem pirmās klases vadītājiem no diviem dažādiem metāli ... Tā rezultātā rodas elektriskā strāva vienā vai otrā virzienā. ”

Vienā no pirmajiem eksperimentiem Volta nolaida divas plāksnes - cinku un varu - skābes burkā un savienoja tās ar stiepli. Pēc tam cinka plāksne sāka izšķīst, un uz vara tērauda izveidojās gāzes burbuļi. Volta ieteica un pierādīja, ka caur vadu plūst elektriskā strāva.
Tādējādi tika izgudrots "Volta elements" - pirmais galvaniskais elements. Ērtības labad Volta viņam piešķīra vertikāla cilindra (stabu) formu, kas sastāv no savstarpēji savienotiem cinka, vara un ar skābi piesūcinātu audumu gredzeniem. Pusmetru augsts voltas pole radīja cilvēkiem jutīgu spriegumu.
Kopš pētījuma sākuma vārdu lika Luigi Galvani ķīmiskās strāvas avots saglabāja piemiņu par viņu savā vārdā.
Galvaniskā šūna Ir ķīmisks elektriskās strāvas avots, kura pamatā ir divu metālu un / vai to oksīdu mijiedarbība elektrolītā, izraisot elektriskās strāvas parādīšanos slēgtā ķēdē. Tādējādi galvaniskajās šūnās ķīmiskā enerģija tiek pārveidota par elektrisko enerģiju.
Šūnas šodien

Šūnas mūsdienās sauc par baterijām. Ir plaši izplatīti trīs veidu akumulatori: fizioloģiskais (sausais), sārmains (tos tulkojumā no angļu valodas sauc arī par sārmainu, “sārmains” - “sārmains”) un litijs. Viņu darba princips ir tāds pats, kā 1800. gadā aprakstīja Volta: divi metāli mijiedarbojas caur elektrolītu, un ārējā slēgtā ķēdē notiek elektriskā strāva.
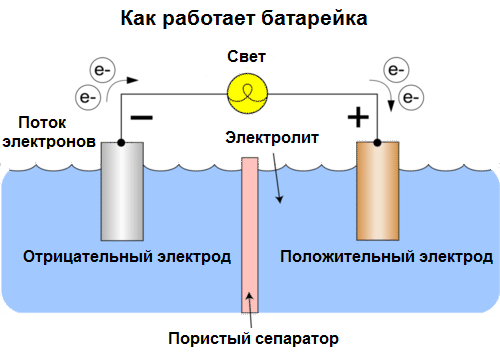
Akumulatora spriegums ir atkarīgs no izmantotajiem metāliem un no "akumulatora" šūnu skaita. Baterijas, atšķirībā no baterijām, nespēj atjaunot to īpašības, jo tās tieši ķīmisko enerģiju, tas ir, reaģentu (reduktora un oksidētāja), kas veido akumulatoru, enerģiju pārvērš elektriskajā enerģijā.
Reaģenti, kas iekļauti akumulatorā, tiek patērēti tā darbības laikā, strāva pakāpeniski samazinās, tāpēc avota darbība beidzas pēc tam, kad reaģenti pilnībā reaģē.
Sārmu un sāls elementi (baterijas) tiek plaši izmantoti, lai darbinātu dažādas elektroniskas ierīces, radioiekārtas, rotaļlietas, un litiju visbiežāk var atrast portatīvās medicīnas ierīcēs, piemēram, glikozes līmeņa mērītājos, vai digitālajās tehnoloģijās, piemēram, kamerās.

Sāls baterijas
Mangāna-cinka šūnas, kuras sauc par sāls baterijām, ir “sausas” galvaniskas šūnas, kuru iekšpusē nav šķidra elektrolīta šķīduma.
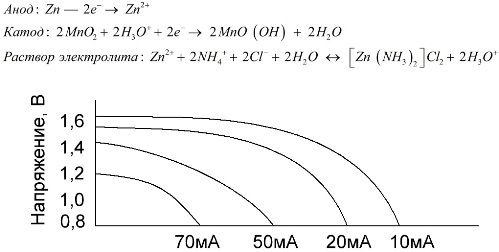
Cinka elektrods (+) ir kausa formas katods, un par anodu kalpo pulverveida mangāna dioksīda un grafīta maisījums. Strāva plūst caur grafīta stieni. Kā elektrolītu pastas izmanto no amonija hlorīda šķīduma, pievienojot cieti vai miltus, lai sabiezētu, lai nekas neplūst.
Parasti akumulatoru ražotāji nenorāda precīzu sāls elementu sastāvu, tomēr sāls akumulatori ir lētākie, tos parasti izmanto ierīcēs, kur enerģijas patēriņš ir ārkārtīgi mazs: stundās, tālvadības pultīs, elektroniskos termometros utt.

Mangāna-cinka bateriju raksturošanai reti izmanto jēdzienu "nominālā ietilpība", jo to ietilpība ir ļoti atkarīga no ekspluatācijas apstākļiem un apstākļiem. Šo elementu galvenie trūkumi ir ievērojams sprieguma samazināšanas ātrums visā izlādē un ievērojams izejas kapacitātes samazinājums, palielinoties izlādes strāvai. Galīgo izlādes spriegumu iestata atkarībā no slodzes diapazonā no 0,7 līdz 1,0 V.
Svarīgs ir ne tikai izlādes strāvas lielums, bet arī slodzes grafiks. Ar neregulāru lielu un vidēju strāvu izlādi akumulatoru veiktspēja ievērojami palielinās, salīdzinot ar nepārtrauktu darbību. Tomēr ar nelielu izlādes strāvu un mēnešiem ilgus pārtraukumus darbībā to izlāde var samazināties.
Iepriekš redzamajā grafikā parādītas vidējās sāls akumulatora izlādes līknes 4, 10, 20 un 40 stundām, salīdzinot ar sārma akumulatoru, par ko tiks runāts vēlāk.
Sārmu (sārmu) baterijas
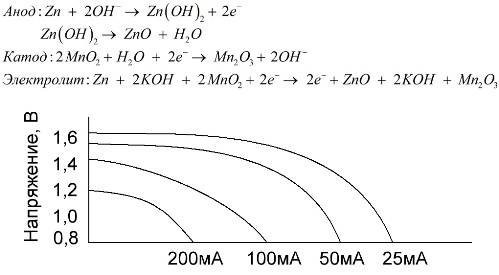
Sārma akumulators ir mangāna-cinka galvaniskais akumulators, kurā kā katodu izmanto mangāna dioksīdu, cinka pulveri - kā anodu, bet kā elektrolītu - sārmu šķīdumu, parasti kālija hidroksīda pastas veidā.
Šīm baterijām ir vairākas priekšrocības (jo īpaši, ievērojami lielāka ietilpība, labāka veiktspēja zemā temperatūrā un liela slodzes strāva).

Sārmu baterijas, salīdzinot ar fizioloģisko šķīdumu, ilgstoši var nodrošināt lielāku strāvu. Lielāka strāva kļūst iespējama, jo cinku šeit izmanto nevis stikla, bet pulvera veidā, kam ir lielāks kontakta laukums ar elektrolītu. Kā elektrolītu izmanto kālija hidroksīdu pastas formā.
Pateicoties šāda veida galvanisko elementu spējai ilgstoši piegādāt ievērojamu strāvu (līdz 1 A), sārma akumulatori pašlaik ir visizplatītākie.
Elektriskajās rotaļlietās, portatīvajā medicīniskajā aprīkojumā, elektroniskajās ierīcēs, kamerās visur izmanto sārmu baterijas. Tie kalpo 1,5 reizes ilgāk nekā fizioloģiskais šķīdums, ja izlādei ir zema strāva. Diagrammā parādītas izlādes līknes pie dažādām strāvām, lai salīdzinātu ar sāls akumulatoru (grafiks tika dots iepriekš) 4, 10, 20 un 40 stundas.
Litija baterijas
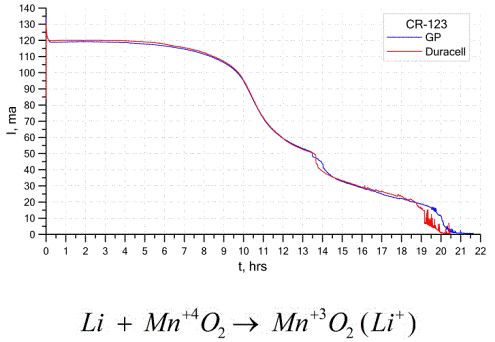
Vēl viens diezgan izplatīts galvanisko elementu tips ir litija akumulatori - vienreizēji neuzlādējami galvaniski elementi, kuros litru vai tā savienojumus izmanto kā anodu. Sārmu metāla izmantošanas dēļ tiem ir liela potenciālu atšķirība.

Litija šūnas katodi un elektrolīti var būt ļoti atšķirīgi, tāpēc termins “litija šūna” apvieno šūnu grupu ar to pašu anoda materiālu.Kā katodu, piemēram, var izmantot mangāna dioksīdu, oglekļa monofluorīdu, pirītu, tionilhlorīdu utt.
Litija baterijas no citām baterijām atšķir ar augstu darbības laiku un augstām izmaksām. Litija akumulators atkarībā no izmēra un izmantotajiem ķīmiskajiem materiāliem var radīt spriegumu no 1,5 V (saderīgs ar sārma akumulatoriem) līdz 3,7 V.
Šīm baterijām ir vislielākā ietilpība masas vienībā un ilgs glabāšanas laiks. Litija šūnas tiek plaši izmantotas modernās pārnēsājamās elektroniskās iekārtās: pulksteņu barošanai uz datoru mātesplatēm, portatīvo medicīnisko ierīču, pulksteņu, kalkulatoru, fotoiekārtu u.c.
Iepriekš redzamajā grafikā parādītas divu populāru ražotāju divu litija bateriju izlādes līknes. Sākotnējā strāva bija 120 mA (uz vienu pretestību 24 omi).
Skatīt arī: Mūsdienu uzlādējamās baterijas - priekšrocības un trūkumi
Skatīt arī vietnē e.imadeself.com
: