Kategorijas: Iesācēju elektriķi, Industriālais elektriķis
Skatījumu skaits: 37528
Komentāri par rakstu: 0
Elektrolīzes praktiskā pielietošana
Kad elektriskā strāva iet caur elektrolīta šķīdumu vai kausējumu, uz elektrodiem izdalās izšķīdināti elektrodi vai citas vielas, kas ir sekundāru reakciju uz elektrodiem rezultāts. Šo fizikāli ķīmisko procesu sauc par elektrolīzi.
Elektrolīzes būtība
Elektrodus radītajā elektriskajā laukā jonus vadošajā šķidrumā izdara noteiktā kustībā. Negatīvs elektrods ir katods, pozitīvs - anods.
Negatīvie joni, kurus sauc par anjoniem (hidroksilgrupas joni un skābju atlikumi), steidzas uz anodu, un pozitīvie joni, ko sauc par katjoniem (ūdeņraža, metāla, amonija joni utt.), Steidzas pie katoda
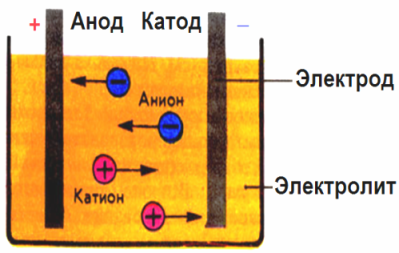
Elektrodos notiek oksidācijas-reducēšanās process: pie katoda notiek daļiņu (atomu, molekulu, katjonu) elektroķīmiskā reducēšana, bet pie anoda notiek daļiņu (atomu, molekulu, anjonu) elektroķīmiskā oksidācija. Disociācijas reakcijas elektrolītā ir primāras reakcijas, un reakcijas, kas notiek tieši pie elektrodiem, sauc par sekundārām.
Faraday elektrolīzes likumi
Elektrolīzes reakciju sadalīšana primārajā un sekundārajā palīdzēja Maiklam Faradejam noteikt elektrolīzes likumus:
-
Pirmais Faradeja elektrolīzes likums: vielas masa, kas nogulsnējas uz elektrodu elektrolīzes laikā, ir tieši proporcionāla uz šo elektrodu nodotās elektroenerģijas daudzumam. Ar elektrības daudzumu tiek domāts elektriskais lādiņš, ko mēra parasti kulonos.
-
Otrais Faraday elektrolīzes likums: noteiktam elektroenerģijas daudzumam (elektriskajam lādiņam) uz elektrodu nogulsnētā ķīmiskā elementa masa ir tieši proporcionāla elementa ekvivalentajai masai. Vielas ekvivalentā masa ir tās molārā masa, dalīta ar veselu skaitli, atkarībā no ķīmiskās reakcijas, kurā viela ir iesaistīta.
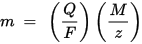
m ir uz elektrodu nogulsnētās vielas masa, Q ir kopējais elektriskais lādiņš, kas iet caur vielu F = 96,485,33 (83) C mol - 1 ir Faradeja konstante, M ir vielas molārā masa (piemēram, ūdens molārā masa H2O = 18 g / mol), z ir vielas jonu valences numurs (elektronu skaits uz jonu).
Ņemiet vērā, ka M / z ir izgulsnētās vielas ekvivalenta masa. Pirmajam Faraday likumam M, F un z ir konstantes, tāpēc jo lielāka ir Q vērtība, jo lielāka ir m vērtība. Otrajam Faradejas likumam Q, F un z ir konstantes, tāpēc jo lielāka ir M / z (ekvivalenta masa) vērtība, jo lielāka ir m vērtība.
Elektrolīze mūsdienās tiek plaši izmantota rūpniecībā un tehnoloģijās. Piemēram, elektrolīze ir viena no efektīvākajām metodēm ūdeņraža, ūdeņraža peroksīda, mangāna dioksīda, alumīnija, nātrija, magnija, kalcija un citu vielu rūpnieciskai ražošanai. Elektrolīzi izmanto notekūdeņu attīrīšanai, galvanizēšanai, galvanizēšanai un, visbeidzot, ķīmisko strāvas avotiem. Bet vispirms viss.
Tīru metālu iegūšana no rūdām elektrolīzes ceļā
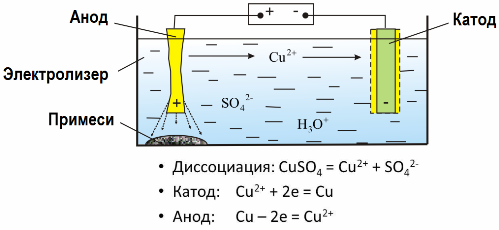
Pateicoties elektrolīzei, daudzi metāli tiek iegūti no rūdām un tiek tālāk apstrādāti. Tātad, kad rūdu vai bagātinātu rūdu - koncentrātu - apstrādā ar reaģentiem, metāls nonāk šķīdumā, un pēc tam, izmantojot elektroekstrakciju, metālu izdala no šķīduma. Vienlaicīgi ar katodu izdalās tīrs metāls. Tādā veidā saņemiet cinku, varu, kadmiju.
Metālus apstrādā ar elektrisko rafinēšanu, lai novērstu piemaisījumus un pārvērstu piemaisījumus tādā formā, kas ir ērta turpmākai pārstrādei. Tīrījamais metāls tiek liets plākšņu veidā, un šīs plāksnes elektrolīzē izmanto kā anodus.
Kad strāva iet, anoda metāls izšķīst, katjonu veidā nonāk šķīdumā, tad katjonus izvada pie katoda un veido tīra metāla nogulsnes. Anoda piemaisījumi nešķīst - tie izgulsnējas ar anoda vircu vai nonāk elektrolītā, no kurienes tos nepārtraukti vai periodiski noņem.
Apsveriet kā piemēru vara elektriskā attīrīšana. Šķīduma galvenā sastāvdaļa - vara sulfāts - visizplatītākais un lētākais šī metāla sāls. Risinājumam ir zema elektrovadītspēja. Lai to palielinātu, elektrolītam pievieno sērskābi.
Turklāt, lai atvieglotu kompaktu metāla nogulsņu veidošanos, šķīdumā ievada nelielu daudzumu piedevu. Parasti vara, niķeļa, svina, alvas, sudraba un zelta elektrolītiskā attīrīšana tiek veikta.
Elektrolīzes notekūdeņu attīrīšana
Elektrolīzi izmanto notekūdeņu attīrīšanā (elektrokoagulācijas, elektroekstrakcijas un elektroflotācijas procesi). Elektroķīmiskās tīrīšanas metode ir viena no visbiežāk izmantotajām. Elektrolīzē izmanto nešķīstošos anodus (magnetu, svina oksīdu, grafītu, mangānu, kas atrodas uz titāna pamatnes) vai šķīstošos (alumīnijs, dzelzs).
Šo metodi izmanto toksisko organisko un neorganisko vielu izolēšanai no ūdens. Piemēram, vara caurules mērogā notīra ar sērskābes šķīdumu, un rūpnieciskie notekūdeņi pēc tam jānotīra elektrolīzē ar nešķīstošu anodu. Varš tiek izlaists pie katoda, ko atkal var izmantot tajā pašā uzņēmumā.
Sārmu notekūdeņi tiek attīrīti ar elektrolīzi no cianīdu savienojumiem. Lai paātrinātu cianīdu oksidāciju, palielinātu elektrisko vadītspēju un taupītu enerģiju, ūdenī izmanto piedevu nātrija hlorīda formā.
Elektrolīzi veic ar grafīta anodu un tērauda katodu. Cianīdi tiek iznīcināti elektroķīmiskās oksidācijas laikā un hlors, kas izdalās uz anoda. Šādas tīrīšanas efektivitāte ir tuvu 100%.
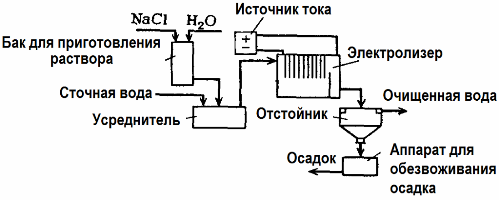
Papildus tiešai elektroķīmiskai tīrīšanai to var iekļaut elektrolīzē koagulācija. Izņemot sāļu pievienošanu, elektrolīzi veic ar šķīstošiem alumīnija vai dzelzs anodiem. Tad tiek iznīcināti ne tikai piesārņotāji uz anoda, bet arī pats anods izšķīst. Veidojas aktīvi disperģēti savienojumi, kas koagulē (sabiezē) koloidāli izkliedētus piesārņotājus.
Šī metode ir efektīva tauku, naftas produktu, krāsvielu, eļļu, radioaktīvo vielu uc notekūdeņu attīrīšanā. To sauc par elektrokoagulāciju.
Galvanizācija
Galvanizācija ir dažu metālu elektrolītiska nogulsnēšanās, lai aizsargātu izstrādājumus no korozijas un iegūtu tiem atbilstošu estētisko izskatu (pārklājums ir izgatavots ar hromu, niķeli, sudrabu, zeltu, platīnu utt.). Lieta tiek rūpīgi notīrīta, attaukota un izmantota kā katods elektrolītiskā vannā, kurā ielej metāla sāls šķīdumu, ar kuru nepieciešams apklāt produktu.
Kā anods tiek izmantota tā paša metāla plāksne. Kā likums, tiek izmantots anodu plākšņu pāris, un starp tām tiek novietots cinkotais priekšmets.
Elektroformēšana
Galvanizācija - metāla nogulsnēšanās uz dažādu ķermeņu virsmas, lai reproducētu to formas: veidnes detaļu liešanai, skulptūras, iespiestas klišejas utt.

Metāla galvaniska nogulsnēšanās uz objekta virsmas ir iespējama tikai tad, ja šī virsma vai viss priekšmets ir elektriskās strāvas vadītājs, tāpēc modeļu vai formu izgatavošanai ieteicams izmantot metālus. Kausējamie metāli ir vispiemērotākie šim nolūkam: svins, alva, lodmetāli, koksnes sakausējums.
Šie metāli ir mīksti, viegli apstrādājami ar metālapstrādes instrumentiem, ir labi iegravēti un lieti. Pēc galvaniskā slāņa izveidošanas un apdares, veidņu metāls tiek kausēts no galaprodukta.
Tomēr vislielākās modeļu ražošanas iespējas joprojām pārstāv dielektriski materiāli. Lai metalizētu šādus modeļus, ir jāpiešķir to virsmas elektriskā vadītspēja. Panākumi vai neveiksmes galu galā galvenokārt ir atkarīgi no vadošā slāņa kvalitātes. Šo slāni var uzklāt vienā no trim veidiem.
Visizplatītākais veids ir grafitizācija, tas ir piemērots plastilīna un citu materiālu modeļiem, kas ļauj slīpēt grafītu uz virsmas.
Nākamais triks ir bronzēšana, metode ir piemērota salīdzinoši sarežģītas formas modeļiem, dažādiem materiāliem, tomēr bronzas slāņa biezuma dēļ nelielu detaļu pārnešana ir nedaudz izkropļota.
Un visbeidzot sudrabošanapiemērots visos gadījumos, bet īpaši neaizstājams trausliem modeļiem ar ļoti sarežģītu formu - augiem, kukaiņiem utt.
Ķīmisko strāvu avoti
Arī elektrolīze ir galvenais process, kura dēļ darbojas vismodernākie ķīmisko strāvas avoti, piemēram, baterijas un akumulatori. Saskarē ar elektrolītu ir divi elektrodi.
Starp elektrodiem tiek noteikta potenciāla starpība - elektromotora spēks, kas atbilst redoksreakcijas brīvajai enerģijai. Skatīt šeit, lai iegūtu sīkāku informāciju: Elektriskās strāvas ķīmiskie avoti
Citronu akumulators (noklikšķiniet, lai palielinātu)
Ķīmisko strāvas avotu darbība ir balstīta uz telpiski atdalītu procesu parādīšanos ar slēgtu ārējo ķēdi: uz negatīvā anoda reducējošais līdzeklis tiek oksidēts, izveidotie brīvie elektroni caur ārējo ķēdi nonāk pozitīvajā katoda vietā, veidojot izlādes strāvu, kur viņi piedalās oksidācijas reducēšanas reakcijā. Tādējādi negatīvi lādētu elektronu plūsma gar ārējo ķēdi iet no anoda uz katodu, tas ir, no negatīvā elektroda uz pozitīvo.
Skatīt arī vietnē e.imadeself.com
: