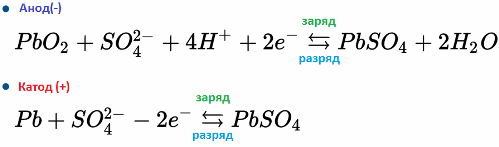Kategorijas: Kā tas darbojas, Auto elektriķis
Skatījumu skaits: 16526
Komentāri par rakstu: 0
Ierīce un akumulatora darbības princips
Tiek saukts elektriskais akumulators atkārtoti lietojams ķīmiskās strāvas avots. Ķīmiskie procesi akumulatora iekšienē, atšķirībā no vienreizlietojamo galvanisko elementu procesiem, piemēram, sārma vai sāls akumulatoriem, ir atgriezeniski. Elektriskās enerģijas lādēšanas, uzkrāšanas un atgriešanās ciklus var atkārtot daudzas reizes.
Tātad, akumulatora darbības princips ļauj to cikliski izmantot dažādu ierīču, pārnēsājamo ierīču, transportlīdzekļu, medicīniskā aprīkojuma utt. Autonomai barošanai pilnīgi dažādās vietās.

Runājot vārdu "akumulators", tie nozīmē vai nu pašu akumulatoru, vai akumulatora elementu. Vairākas virknes vai paralēlas, kas savienotas viena ar otru, akumulatora elementi veido akumulatoru, kā arī vairākas savienotas baterijas.
Pirmais akumulators, tas ir, atkārtoti lietojams galvaniskais elements, saskaņā ar oficiālajiem datiem parādījās 1803. gadā. To izveidoja vācu fiziķis un ķīmiķis Johans Vilhelms Riters. Oersteda draugs Riters, nebūdams zinātnieks, pētīja gaismas ķīmisko iedarbību, veica eksperimentus ar elektrolīzi, starp citu, viņš pieder elektromagnētiskā spektra ultravioletās daļas atklāšanai.
Eksperimentējot ar voltaīnu kolonnu, Riters paņēma piecdesmit vara apļus, mitra auduma gabalus un izveidoja starp tiem piecdesmit šādu apļu kolonnu un mitru audumu. Caur konstrukciju, izejot no strāvas kolonnas, Riters atklāja, ka viņa stabs ir uzlādēts un pats kļūst par elektrības avotu. Šī bija pirmā baterija.
Ķīmiskās reakcijas atgriezeniskums elektrolītā un uz akumulatora elektrodiem ļauj atjaunot akumulatora efektivitāti - uzlādēt to pēc izlādes. Strāva lādēšanas laikā caur akumulatoru tiek izvadīta pretējā virzienā pret izlādi.
Piemēram, svina-skābes akumulators darbojas svina un svina dioksīda sērskābes elektroķīmisko reakciju dēļ. Zemāk redzamās formulas atspoguļo atgriezeniskas reakcijas, kas notiek uz anoda un katoda: no kreisās uz labo - reakcija izlādes laikā, no labās uz kreiso - lādiņš.
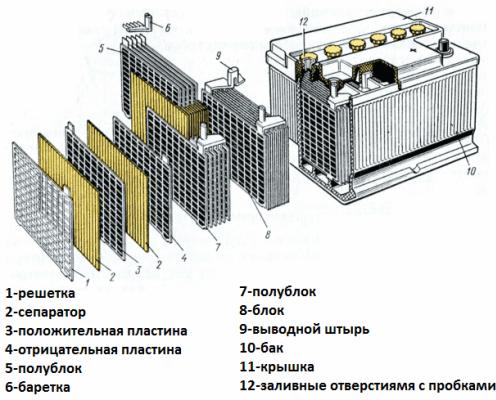
Tagad apsveriet akumulatora ierīci kā automašīnas startera akumulatora piemēru. Tās spriegums ir 12 volti. Akumulators sastāv no sešām šūnām, kas savienotas virknē, atdalītas ar starpsienām.
Sērijas savienojums šajā gadījumā nozīmē, ka vienas šūnas negatīvais spailis ir savienots ar nākamās šūnas pozitīvo spaili.
Katrā elementā ietilpst svina-antimona sakausējuma režģa elektrodu pāris, kas iegremdēti elektrolītā, kas ir 38% sērskābes ūdens šķīdums. Porainā atdalītāja elektrodus izolē viens no otra, novēršot īssavienojumus starp tiem, bet elektrolītu brīvi izlaiž caur sevi. Tas ir, šķidrums aizpilda gan svina plākšņu šūnas, gan atdalītāju poras.
Tā paša nosaukuma plāksnes ir savstarpēji savienotas ar svina džemperiem, kā arī ar starpsienām atdalītas plākšņu paketes, kas veido atsevišķus elementus, un akumulatora spailes ir izgatavotas arī no svina.
Automašīnas akumulatora secinājumi vienmēr ir nedaudz atšķirīgi viens no otra - pozitīvā spailes diametrs ir lielāks nekā negatīvā, lai, savienojot, netiktu pieļauta kļūda.
Akumulatora korpuss ir izgatavots no dielektriska materiāla, kas izturīgs pret agresīvu vidi, temperatūras galējībām un vibrācijām. Mūsdienās starta akumulatoru korpusi ir izgatavoti no polipropilēna.
Korpuss ir hermētiski noslēgts konteiners ar vāku, kas aprīkots ar atlokiem izturīgai stiprināšanai.Veco bateriju gadījumā katram galvaniskajam elementam, kas veido akumulatoru, vienmēr ir pievienoti kontaktdakšas, lai vajadzības gadījumā varētu pievienot destilētu ūdeni. Mūsdienu akumulatoru kontaktdakšu, kurām nav nepieciešama apkope, nav.
Citi raksti par baterijām un to lietošanu:
Akumulatora pievienošanas shēmas
Kā ir saules elektrostaciju baterijām
Skatīt arī vietnē e.imadeself.com
: