Kategorie: Začátečníci elektrikáři, Průmyslový elektrikář
Počet zobrazení: 37528
Komentáře k článku: 0
Praktická aplikace elektrolýzy
Když elektrický proud prochází roztokem nebo taveninou elektrolytu, uvolňují se na elektrody soluty nebo jiné látky, které jsou produkty sekundárních reakcí na elektrodách. Tento fyzikálně-chemický proces se nazývá elektrolýza.
Podstata elektrolýzy
V elektrickém poli vytvořeném elektrodami přicházejí ionty ve vodivé tekutině v uspořádaném pohybu. Záporná elektroda je katoda, pozitivní je anoda.
Negativní ionty nazývané anionty (ionty hydroxylové skupiny a kyselé zbytky) spěchají k anodě a pozitivní ionty nazývané kationty (vodíkové, kovové, amonné ionty atd.) Spěchají na katodu
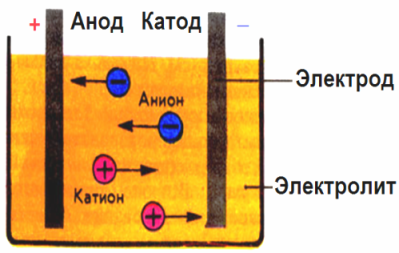
Na elektrodách probíhá oxidačně-redukční proces: na katodě dochází k elektrochemické redukci částic (atomů, molekul, kationtů) a na anodě dochází k elektrochemické oxidaci částic (atomů, molekul, aniontů). Disociační reakce v elektrolytu jsou primární reakce a reakce, které probíhají přímo na elektrodách, se nazývají sekundární.
Zákony Faradayovy elektrolýzy
Rozdělení elektrolytických reakcí na primární a sekundární pomohlo Michaelu Faradayovi stanovit zákony elektrolýzy:
-
První zákon Faradayovy elektrolýzy: hmotnost látky uložené na elektrodě během elektrolýzy je přímo úměrná množství elektřiny přenesené na tuto elektrodu. Množstvím elektřiny se míní elektrický náboj, měřený zpravidla u přívěsků.
-
Druhý zákon Faradayovy elektrolýzy: pro dané množství elektřiny (elektrický náboj) je hmotnost chemického prvku uloženého na elektrodě přímo úměrná ekvivalentní hmotnosti prvku. Ekvivalentní hmotnost látky je její molární hmotnost dělená celým číslem v závislosti na chemické reakci, ve které se látka podílí.
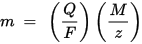
m je hmotnost látky uložené na elektrodě, Q je celkový elektrický náboj procházející látkou F = 96,485,33 (83) C mol - 1 je Faradayova konstanta, M je molární hmotnost látky (například molární hmotnost vody H2O = 18 g / mol), z je valenční počet iontů látky (počet elektronů na ion).
Všimněte si, že M / z je ekvivalentní hmotnost vysrážené látky. Pro první Faradayův zákon jsou M, F a z konstanty, takže čím větší je hodnota Q, tím větší je hodnota m. Pro druhý Faradayův zákon jsou Q, F a z konstanty, takže čím větší je hodnota M / z (ekvivalentní hmotnost), tím větší je hodnota m.
Elektrolýza je dnes široce používána v průmyslu a v technologii. Například je to elektrolýza, která slouží jako jedna z nejúčinnějších metod pro průmyslovou výrobu vodíku, peroxidu vodíku, oxidu manganičitého, hliníku, sodíku, hořčíku, vápníku a dalších látek. Elektrolýza se používá k čištění odpadních vod, při elektrolytickém pokovování, při elektrolytickém pokovování a nakonec v chemických zdrojích proudu. Nejdříve ale první.
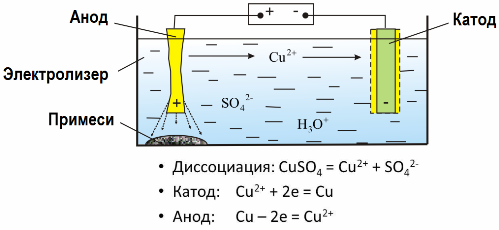
Získávání čistých kovů z rud elektrolýzou
Díky elektrolýze je mnoho kovů extrahováno z rud a podrobeno dalšímu zpracování. Když je tedy ruda nebo obohacený rudný koncentrát zpracováván činidly, kov přechází do roztoku, potom je kov extrahován z roztoku elektroextrakcí. Čistý kov se uvolňuje současně na katodě. Tímto způsobem přijímat zinek, měď, kadmium.
Kovy jsou podrobeny elektrolytickému rafinování, aby se odstranily nečistoty a převedly se obsažené nečistoty do formy vhodné pro další zpracování. Kov, který má být čištěn, je odlit ve formě desek a tyto desky se používají jako anody při elektrolýze.
Když proud prochází, kov anody se rozpustí, prochází ve formě kationtů do roztoku, pak jsou kationty vypouštěny na katodě a vytvářejí sraženinu čistého kovu. Nečistoty anody se nerozpouštějí - precipitují s anodovou suspenzí nebo přecházejí do elektrolytu, odkud jsou průběžně nebo periodicky odstraňovány.
Vezměme si za příklad měděná elektrická rafinace. Hlavní složkou roztoku - síran měďnatý - nejběžnější a nejlevnější sůl tohoto kovu. Řešení má nízkou elektrickou vodivost. K jeho zvýšení se do elektrolytu přidá kyselina sírová.
Kromě toho se do roztoku přidává malá množství přísad, aby se usnadnila tvorba kompaktní kovové sraženiny. Obecně se měď, nikl, olovo, cín, stříbro a zlato podrobují elektrolytické rafinaci.
Elektrolýza čištění odpadních vod
Elektrolýza se používá při čištění odpadních vod (procesy elektrokoagulace, elektroextrakce a elektroflotace). Elektrochemická metoda čištění je jednou z nejčastěji používaných metod. Pro elektrolýzu se používají nerozpustné anody (magnetit, oxid olovnatý, grafit, mangan, které se ukládají na bázi titanu) nebo rozpustné (hliník, železo).
Tato metoda se používá k oddělení toxických organických a anorganických látek od vody. Například měděné trubky jsou očištěny od vodního kamene roztokem kyseliny sírové a průmyslové odpadní vody musí být poté vyčištěny elektrolýzou s nerozpustnou anodou. Měď se uvolňuje na katodě, kterou lze znovu použít ve stejném podniku.
Alkalická odpadní voda se čistí elektrolýzou z kyanidových sloučenin. Pro urychlení oxidace kyanidů, zvýšení elektrické vodivosti a úspory energie se ve vodě používá aditivum ve formě chloridu sodného.
Elektrolýza se provádí grafitovou anodou a ocelovou katodou. Kyanidy se ničí během elektrochemické oxidace a chloru, který se uvolňuje na anodě. Účinnost takového čištění je téměř 100%.
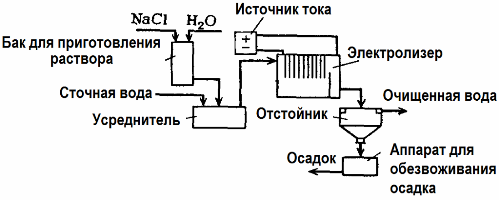
Kromě přímého elektrochemického čištění může být zahrnut do procesu elektrolýzy koagulace. S výjimkou přísad do solí se elektrolýza provádí s rozpustnými anodami z hliníku nebo železa. Pak jsou zničeny nejen nečistoty na anodě, ale samotná anoda se rozpustí. Vznikají aktivní dispergované sloučeniny, které koagulují (zahušťují) koloidní dispergované kontaminanty.
Tato metoda je účinná při čištění odpadních vod z tuků, ropných produktů, barviv, olejů, radioaktivních látek atd. Nazývá se elektrokoagulace.
Galvanizace
Galvanizace je elektrolytická depozice určitých kovů za účelem ochrany produktů před korozí a poskytnutí jim vhodného estetického vzhledu (povlak je vyroben z chrómu, niklu, stříbra, zlata, platiny atd.). Věc je důkladně vyčištěna, odmaštěna a použita jako katoda v elektrolytické lázni, ve které se nalije solný roztok kovu, kterým je nutné povlékat produkt.
Jako anoda se používá destička ze stejného kovu. Zpravidla se používá dvojice anodových desek a mezi ně se umístí galvanizovaný předmět.
Elektroformování
Galvanické pokovování - nanášení kovu na povrch různých těles k reprodukci jejich tvarů: formy pro lití dílů, sochy, tištěné klišé atd.

Galvanické nanášení kovu na povrch předmětu je možné pouze tehdy, je-li tento povrch nebo celý objekt vodičem elektrického proudu, proto je vhodné používat kovy k vytváření modelů nebo forem. K tomuto účelu jsou nejvhodnější tavné kovy: olovo, cín, pájky, slitina dřeva.
Tyto kovy jsou měkké, snadno se zpracovávají kovovými nástroji, jsou dobře vyryty a odlitky. Po vytvoření galvanické vrstvy a dokončení se kov formy vytaví z hotového výrobku.
Největší příležitosti pro výrobu modelů však stále představují dielektrické materiály. K metalizaci takových modelů je nutné dát jejich povrchovou elektrickou vodivost. Úspěch nebo neúspěch závisí v konečném důsledku hlavně na kvalitě vodivé vrstvy. Tuto vrstvu lze aplikovat jedním ze tří způsobů.
Nejběžnějším způsobem je grafitizace, je vhodný pro modely z plastelíny a dalších materiálů, které umožňují broušení grafitu na povrchu.
Další trik je bronzování, metoda je dobrá pro modely relativně složitého tvaru, pro různé materiály, ale kvůli tloušťce bronzové vrstvy je přenos malých detailů poněkud zkreslený.
A konečně stříbrovhodný ve všech případech, ale zejména nezbytný pro křehké modely s velmi složitým tvarem - rostliny, hmyz atd.
Zdroje chemického proudu
Elektrolýza je také hlavním procesem, díky kterému fungují nejmodernější chemické zdroje proudu, jako jsou baterie a akumulátory. S elektrolytem jsou v kontaktu dvě elektrody.
Mezi elektrodami se vytváří potenciální rozdíl - elektromotorická síla odpovídající volné energii redoxní reakce. Více informací naleznete zde: Chemické zdroje elektrického proudu
Citronová baterie (pro zvětšení klikněte na obrázek)
Působení zdrojů chemického proudu je založeno na výskytu prostorově oddělených procesů s uzavřeným vnějším obvodem: na záporné anodě je oxidační činidlo oxidováno, volné elektrony, které se vytvářejí, procházejí vnějším obvodem do kladné katody a vytvářejí výbojový proud, kde se podílejí na oxidační redukční reakci. Tok negativně nabitých elektronů podél vnějšího obvodu tedy vede od anody ke katodě, tj. Od záporné elektrody k pozitivní.
Viz také na e.imadeself.com
: