категории: Препоръчани статии » Новаци електротехници
Брой преглеждания: 70526
Коментари към статията: 0
Галванични клетки - устройство, принцип на работа, видове и основни характеристики
Предпоставки за появата на галванични клетки. Малко история. През 1786 г. италианският професор по медицина, физиологът Луиджи Алоисио Галвани открил интересно явление: мускулите на задните крака на прясно отворен труп от жаба, окачен на медни куки, свиват, когато ученият ги докосва със стоманен скалпел. Галвани веднага заключи, че това е проява на „животинско електричество“.
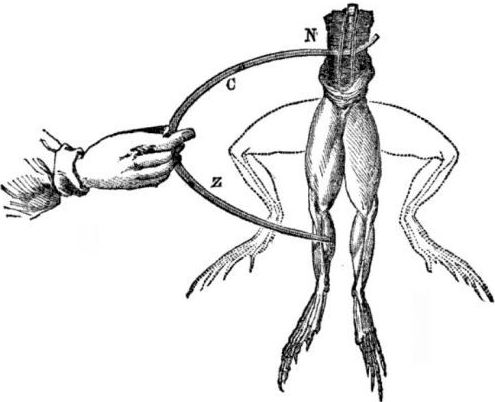
След смъртта на Галвани неговият съвременник Алесандро Волта като химик и физик ще опише и публично ще демонстрира по-реалистичен механизъм за възникване на електрически ток, когато различни метали влизат в контакт.
След серия от експерименти Волта ще стигне до недвусмисленото заключение, че токът се появява във веригата поради наличието в него на два проводника от различни метали, поставени в течност и това изобщо не е „животинско електричество“, както смяташе Галвани. Изтръпването на краката на жабата беше следствие от действието на тока, произтичащ от контакта на различни метали (медни куки и стоманен скалпел).
Волта ще покаже същите явления, които Галвани показа на мъртва жаба, но на напълно неодушевен домашен електрометър и през 1800 г. ще даде точно обяснение на тока: „проводникът от втори клас (течност) е в средата и контактува с два първокласни проводника на два различни метали ... В резултат на това възниква електрически ток в една или друга посока. "

В един от първите експерименти Волта спусна две чинии - цинк и мед - в буркан с киселина и ги свърза с тел. След това цинковата плоча започна да се разтваря и върху медната стомана се образуваха газови мехурчета. Волта предложи и доказа, че електрическият ток тече през жицата.
Така е измислен „елементът Волта“ - първата галванична клетка. За удобство Волта му придаде формата на вертикален цилиндър (стълб), състоящ се от взаимосвързани пръстени от цинк, мед и плат, импрегнирани с киселина. Волтов полюс с височина половин метър създава напрежение, чувствително към хората.
От началото на изследванията е положено от Луиджи Галвани, името химически източник на ток запазил спомена за него на негово име.
Галванична клетка Химичен източник на електрически ток, основан на взаимодействието на два метала и / или техните оксиди в електролит, което води до появата на електрически ток в затворена верига. Така в галваничните клетки химическата енергия се преобразува в електрическа.
Клетки днес

Клетките днес се наричат батерии. Три вида батерии са широко разпространени: физиологични (сухи), алкални (те се наричат още алкални, "алкални" в превод от английски - "алкални") и литиеви. Принципът на тяхната работа е същият, както е описан от Волта през 1800 г.: два метала взаимодействат чрез електролит, и във външен затворен кръг възниква електрически ток.
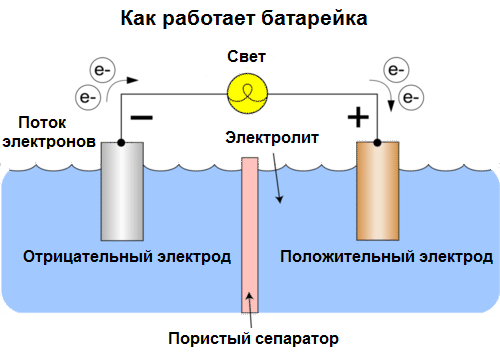
Напрежението на батерията зависи от използваните метали и от броя на клетките в "батерията". Батериите, за разлика от батериите, не са в състояние да възстановят свойствата си, тъй като те директно преобразуват химическата енергия, т.е.
Реагентите, включени в батерията, се изразходват по време на нейната работа, токът постепенно намалява, така че действието на източника приключва, след като реагентите напълно реагират.
Алкалните и солевите елементи (батериите) се използват широко за захранване на различни електронни устройства, радио оборудване, играчки и литий най-често могат да бъдат намерени в преносими медицински устройства, като измерватели на кръвна захар или в цифрови технологии като камери.

Солени батерии
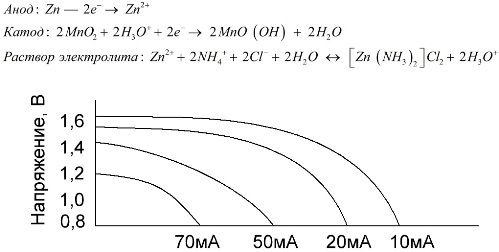
Мангано-цинковите клетки, които се наричат солни батерии, са „сухи“ галванични клетки, вътре в които няма разтвор на течен електролит.
Цинков електрод (+) е катоден като катоден прах, а прахообразна смес от манганов диоксид и графит служи като анод. Ток тече през графитен прът. Като електролит се използва паста от разтвор на амониев хлорид с добавяне на нишесте или брашно за сгъстяване, така че да не тече нищо.
Обикновено производителите на батерии не посочват точния състав на солените елементи, обаче солените батерии са най-евтините, обикновено се използват в устройства, където консумацията на енергия е изключително ниска: за часове, за дистанционно управление, за електронни термометри и т.н.

Понятието "номинален капацитет" рядко се използва за характеризиране на манганово-цинкови батерии, тъй като капацитетът им силно зависи от условията и условията на работа. Основните недостатъци на тези елементи са значителна скорост на намаляване на напрежението през целия разряд и значително намаляване на изходния капацитет с увеличаване на разрядния ток. Крайното напрежение на разреждане се задава в зависимост от натоварването в диапазона 0,7-1,0 V.
Важно е не само големината на тока на разреждане, но и графикът на натоварването. С периодичните разряди на големи и средни токове работата на батериите се увеличава значително в сравнение с продължителната работа. Въпреки това, при малки разрядни токове и месеци прекъсвания в работата им капацитетът може да намалее в резултат на саморазряд.
Графиката по-горе показва кривите на разреждане на средна солна батерия за 4, 10, 20 и 40 часа за сравнение с алкална, които ще бъдат разгледани по-късно.
Алкални (алкални) батерии
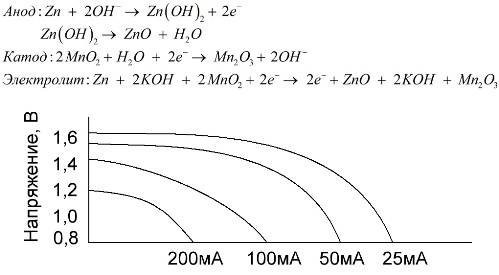
Алкална батерия е галванична батерия от манган-цинк, при която манганов диоксид се използва като катод, прахът на цинк се използва като анод, а алкален разтвор се използва като електролит, обикновено под формата на калиев хидроксиден паст.
Тези батерии имат редица предимства (по-специално, значително по-голям капацитет, по-добри показатели при ниски температури и високи токове на натоварване).

Алкалните батерии, в сравнение с физиологичния разтвор, могат да осигурят повече ток за дълго време. По-голям ток става възможен, защото цинкът се използва тук не под формата на чаша, а под формата на прах, имащ по-голяма контактна зона с електролита. Калиев хидроксид под формата на паста се използва като електролит.
Благодарение на способността на този тип галванични клетки да доставят значителен ток (до 1 A) за дълго време, алкалните батерии са най-често срещани в момента.
В електрическите играчки, в преносимото медицинско оборудване, в електронните устройства, в камерите навсякъде се използват алкални батерии. Те служат 1,5 пъти по-дълго от физиологичния разтвор, ако разрядът е с нисък ток. Графиката показва кривите на разреждане при различни токове за сравнение със солена батерия (графиката е дадена по-горе) за 4, 10, 20 и 40 часа.
Литиеви батерии
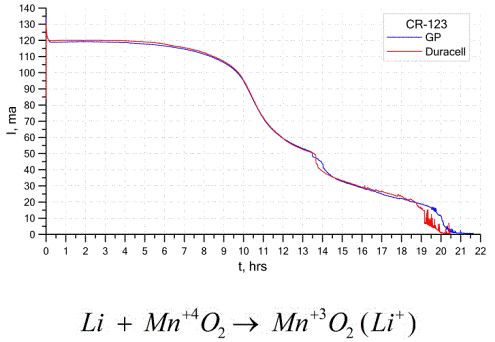
Друг доста често срещан вид галванични клетки са литиевите батерии - единични нерезареждащи се галванични клетки, в които литий или неговите съединения се използват като анод. Поради използването на алкален метал, те имат висока потенциална разлика.

Катодът и електролитът на литиева клетка могат да бъдат много различни, така че терминът "литиева клетка" комбинира група клетки с един и същ аноден материал.Като катод могат да се използват например манганов диоксид, въглероден монофлуорид, пирит, тионилхлорид и др.
Литиевите батерии се отличават от другите батерии по високата им продължителност и висока цена. В зависимост от избрания размер и използваните химически материали, литиевата батерия може да генерира напрежения от 1,5 V (съвместими с алкални батерии) до 3,7 V.
Тези батерии имат най-голям капацитет на единица маса и дълъг срок на годност. Литиевите клетки се използват широко в съвременното преносимо електронно оборудване: за захранване на часовници на компютърни дънни платки, за захранване на преносими медицински устройства, часовници, калкулатори, във фотографско оборудване и др.
Графиката по-горе показва кривите на разреждане на две литиеви батерии от два популярни производителя. Първоначалният ток беше 120 mA (на резистор от порядъка на 24 ома).
Вижте също: Модерни акумулаторни батерии - предимства и недостатъци
Вижте също на e.imadeself.com
: