Kategorie: Vybrané články » Začátečníci elektrikáři
Počet zobrazení: 70526
Komentáře k článku: 0
Galvanické články - zařízení, princip činnosti, typy a hlavní charakteristiky
Předpoklady pro vzhled galvanických článků. Trocha historie. V roce 1786 objevil italský profesor medicíny, fyziolog Luigi Aloisio Galvani zajímavý jev: svaly zadních nohou čerstvě otevřené mrtvoly žáby zavěšené na měděných háčcích se stáhly, když se jich vědec dotkl ocelovým skalpelem. Galvani okamžitě dospěl k závěru, že se jedná o projev „živočišné elektřiny“.
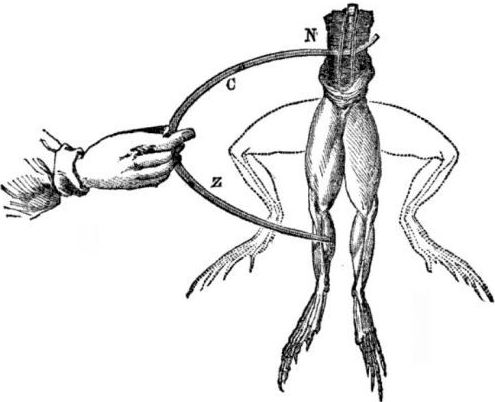
Po smrti Galvaniho bude jeho současný Alessandro Volta jako chemik a fyzik popsat a veřejně demonstrovat realističtější mechanismus výskytu elektrického proudu při kontaktu různých kovů.
Volta po sérii experimentů dospěje k jednoznačnému závěru, že v obvodu se objevuje proud kvůli přítomnosti dvou vodičů různých kovů vložených do kapaliny, a to vůbec není „živočišná elektřina“, jak si myslel Galvani. Zášklby žabích nohou byly důsledkem působení proudu vyplývajícího z kontaktu různých kovů (měděné háčky a ocelový skalpel).
Volta ukáže stejné jevy, které Galvani ukázal na mrtvé žábě, ale na zcela neživém domácím elektroměru, a v roce 1800 poskytne přesné vysvětlení proudu: „dirigent druhé třídy (kapalina) je uprostřed a je v kontaktu se dvěma prvotřídními dirigenty dvou různých kovy ... V důsledku toho vzniká elektrický proud v jednom nebo druhém směru. “

V jednom z prvních experimentů Volta spustil dvě misky - zinek a měď - do sklenice s kyselinou a spojil je drátem. Poté se zinková deska začala rozpouštět a na měděné oceli se tvořily plynové bubliny. Volta navrhl a dokázal, že elektrický vodič protéká drátem.
Tak byl vynalezen „Volta buňka“ - první galvanická buňka. Pro pohodlí dal Volta tvar svislého válce (sloupu), sestávajícího z propojených prstenů zinku, mědi a tkaniny napuštěné kyselinou. Voltový pól vysoký půl metru vytvořil napětí citlivé na člověka.
Od začátku výzkumu byl položen název Luigi Galvani zdroj chemického proudu zachoval v jeho jménu vzpomínku na něj.
Galvanická buňka Je chemickým zdrojem elektrického proudu založeného na interakci dvou kovů a / nebo jejich oxidů v elektrolytu, což vede ke vzniku elektrického proudu v uzavřeném obvodu. V galvanických článcích je tedy chemická energie přeměněna na elektrickou energii.
Buňky dnes

Buňky se dnes nazývají baterie. Jsou rozšířeny tři typy baterií: slaný (suchý), alkalický (v překladu z angličtiny se také nazývají alkalické, „alkalické“) a lithium. Princip jejich práce je stejný jako popsal Volta v roce 1800: dva kovy interagovat prostřednictvím elektrolytua v externím uzavřeném obvodu vzniká elektrický proud.
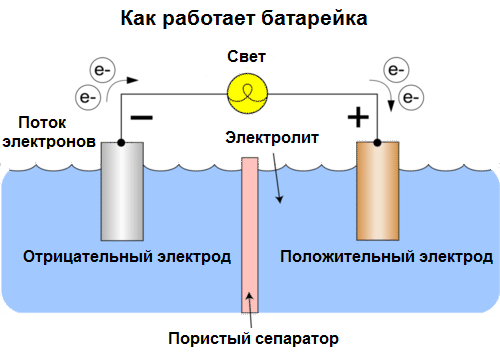
Napětí baterie závisí na použitých kovech a na počtu článků v „baterii“. Baterie, na rozdíl od baterií, nejsou schopny obnovit své vlastnosti, protože přímo přeměňují chemickou energii, tj. Energii činidel (redukčních a oxidačních), které tvoří baterii, na elektrickou energii.
Činidla obsažená v baterii se během provozu spotřebovávají, proud se postupně snižuje, a proto činnost zdroje končí, když reagenty zcela reagují.
Alkalické a solné prvky (baterie) se široce používají k napájení různých elektronických zařízení, rádiových zařízení, hraček a lithium lze nejčastěji nalézt v přenosných zdravotnických zařízeních, jako jsou měřiče krevní glukózy nebo digitální technologie, jako jsou fotoaparáty.

Solné baterie
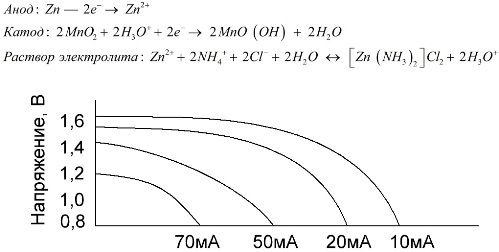
Mangan-zinkové články, které se nazývají solné baterie, jsou „suché“ galvanické články, ve kterých není tekutý elektrolyt.
Zinková elektroda (+) je kalíškovitá katoda a jako anoda slouží prášková směs oxidu manganičitého a grafitu. Proud teče přes grafitovou tyč. Jako elektrolyt se používá pasta z roztoku chloridu amonného s přídavkem škrobu nebo mouky zahušťování, takže nic neteče.
Výrobci baterií obvykle neukazují přesné složení solných prvků, avšak solné baterie jsou nejlevnější, obvykle se používají v zařízeních, kde je spotřeba energie extrémně nízká: v hodinách, v dálkových ovladačích, v elektronických teploměrech atd.

Pojem „jmenovitá kapacita“ se málokdy používá k charakterizaci mangan-zinkových baterií, protože jejich kapacita je vysoce závislá na provozních podmínkách a podmínkách. Hlavní nevýhodou těchto prvků je výrazná míra snížení napětí v průběhu vybíjení a významné snížení výstupní kapacity se zvyšujícím se vybíjecím proudem. Konečné vybíjecí napětí je nastaveno v závislosti na zatížení v rozsahu 0,7-1,0 V.
Je důležité nejen velikost vybíjecího proudu, ale také časový rozvrh zátěže. Při přerušovaném vybíjení velkých a středních proudů se výkon baterií ve srovnání s nepřetržitým provozem výrazně zvyšuje. Avšak s malými výbojovými proudy a měsíci přerušení provozu se jejich kapacita může v důsledku samovybíjení snížit.
Výše uvedený graf ukazuje křivky vybití průměrné slané baterie po dobu 4, 10, 20 a 40 hodin pro porovnání s alkalickou baterií, která bude probrána později.
Alkalické (alkalické) baterie
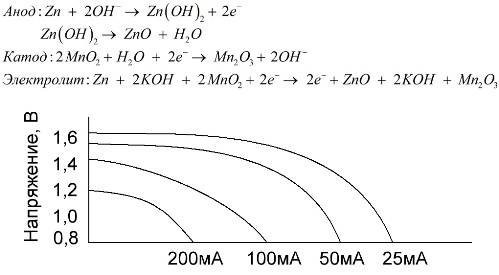
Alkalická baterie je galvanická baterie mangan-zinek, ve které se jako katoda používá oxid manganičitý, jako anoda se používá práškový zinek a jako elektrolyt se používá alkalický roztok, obvykle ve formě pasty hydroxidu draselného.
Tyto baterie mají řadu výhod (zejména výrazně větší kapacitu, lepší výkon při nízkých teplotách a vysoké zátěžové proudy).

Alkalické baterie, ve srovnání se solnými, mohou poskytovat delší proud delší dobu. Vyšší proud je možný, protože zde není použit zinek ve formě skla, ale ve formě prášku majícího větší kontaktní plochu s elektrolytem. Jako elektrolyt se používá hydroxid draselný ve formě pasty.
Je to díky schopnosti tohoto typu galvanických článků dodávat po dlouhou dobu významný proud (až 1 A), v současné době jsou nejběžnější alkalické baterie.
V elektrických hračkách, v přenosných lékařských zařízeních, v elektronických zařízeních, v fotoaparátech se všude používají alkalické baterie. Slouží 1,5krát déle než fyziologický roztok, je-li výboj nízký. Graf ukazuje křivky výboje v různých proudech pro srovnání se slanou baterií (graf byl uveden výše) po dobu 4, 10, 20 a 40 hodin.
Lithiové baterie
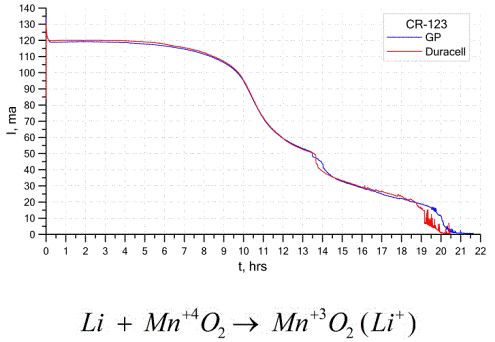
Dalším docela běžným typem galvanických článků jsou lithiové baterie - jednotlivé nenabíjecí galvanické články, ve kterých se lithium nebo jeho sloučeniny používají jako anoda. Díky použití alkalického kovu mají velký rozdíl potenciálů.

Katoda a elektrolyt lithiového článku se mohou velmi lišit, takže termín „lithiový článek“ kombinuje skupinu článků se stejným materiálem anody.Jako katodu lze použít například oxid manganičitý, monofluorid uhlíku, pyrit, thionylchlorid atd.
Lithiové baterie se liší od ostatních baterií vysokou dobou provozu a vysokou cenou. V závislosti na vybrané velikosti a použitých chemických materiálech může lithiová baterie produkovat napětí od 1,5 V (kompatibilní s alkalickými bateriemi) do 3,7 V.
Tyto baterie mají nejvyšší kapacitu na jednotku hmotnosti a dlouhou životnost. Lithiové články se široce používají v moderních přenosných elektronických zařízeních: pro napájení hodinek na základních deskách počítače, pro napájení přenosných zdravotnických zařízení, hodinek, kalkulaček, ve fotografickém vybavení atd.
Výše uvedený graf ukazuje křivky vybití dvou lithiových baterií od dvou oblíbených výrobců. Počáteční proud byl 120 mA (na rezistor řádově 24 Ohmů).
Viz také na e.imadeself.com
: