Kategorie: Polecane artykuły » Początkujący elektrycy
Liczba wyświetleń: 70526
Komentarze do artykułu: 0
Ogniwa galwaniczne - urządzenie, zasada działania, rodzaje i główne cechy
Warunki wstępne dotyczące pojawienia się ogniw galwanicznych. Trochę historii. W 1786 roku włoski profesor medycyny, fizjolog Luigi Aloisio Galvani odkrył interesujące zjawisko: mięśnie tylnych nóg świeżo otwartego zwłok żaby zawieszonej na miedzianych haczykach skurczyły się, gdy naukowiec dotknął ich stalowym skalpelem. Galvani natychmiast stwierdził, że był to przejaw „elektryczności zwierzęcej”.
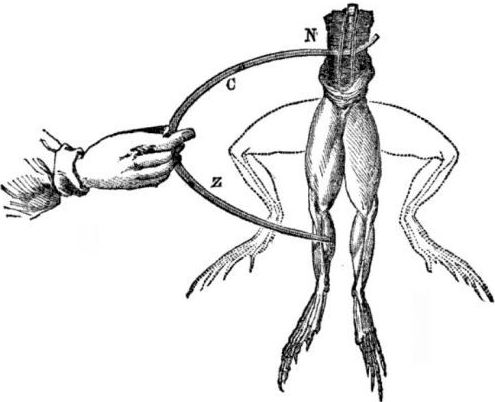
Po śmierci Galvaniego jego współczesny Alessandro Volta, jako chemik i fizyk, opisze i publicznie zaprezentuje bardziej realistyczny mechanizm występowania prądu elektrycznego w kontakcie z różnymi metalami.
Po serii eksperymentów Volta dojdzie do jednoznacznego wniosku, że prąd pojawia się w obwodzie z powodu obecności w nim dwóch przewodników różnych metali umieszczonych w cieczy, a to wcale nie jest „elektryczność zwierzęca”, jak myślał Galvani. Drganie nóg żaby było konsekwencją działania prądu powstającego w wyniku kontaktu różnych metali (miedzianych haczyków i stalowego skalpela).
Volta pokaże te same zjawiska, które Galvani pokazał na martwej żabie, ale na całkowicie nieożywionym elektrometrze domowej roboty, a w 1800 r. Da dokładne wyjaśnienie prądu: „przewodnik drugiej klasy (ciecz) jest w środku i styka się z dwoma pierwszorzędnymi przewodnikami dwóch różnych metale ... W wyniku tego powstaje prąd elektryczny w tym lub innym kierunku. ”

W jednym z pierwszych eksperymentów Volta obniżył dwie płytki - cynk i miedź - do słoika kwasu i połączył je drutem. Następnie płyta cynkowa zaczęła się rozpuszczać, a na miedzianej stali powstały pęcherzyki gazu. Volta zasugerował i udowodnił, że przez drut przepływa prąd elektryczny.
W ten sposób wynaleziono „element Volta” - pierwsze ogniwo galwaniczne. Dla wygody Volta nadał mu kształt pionowego cylindra (filaru), składającego się z połączonych ze sobą pierścieni cynku, miedzi i tkaniny impregnowanych kwasem. Biegun wolta o wysokości pół metra wytworzył napięcie wrażliwe na ludzi.
Od początku badań Luigi Galvani położył nazwę źródło prądu chemicznego zachował pamięć o nim w swoim imieniu.
Ogniwo galwaniczne Jest chemicznym źródłem prądu elektrycznego, opartym na oddziaływaniu dwóch metali i / lub ich tlenków w elektrolicie, prowadzącym do pojawienia się prądu elektrycznego w obwodzie zamkniętym. Tak więc w ogniwach galwanicznych energia chemiczna jest przekształcana w energię elektryczną.
Cells Today

Ogniwa nazywane są dzisiaj bateriami. Rozpowszechnione są trzy rodzaje baterii: solanka (sucha), alkaliczna (zwane również alkalicznymi, „alkaliczne” w tłumaczeniu z angielskiego - „alkaliczne”) i litowe. Zasada ich pracy jest taka sama, jak opisana przez Volta w 1800: dwa metale oddziaływać przez elektrolit, a prąd elektryczny powstaje w zewnętrznym obwodzie zamkniętym.
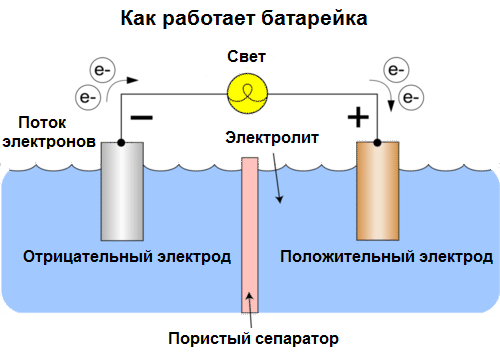
Napięcie akumulatora zależy od użytych metali i liczby ogniw w „akumulatorze”. Baterie, w przeciwieństwie do baterii, nie są w stanie przywrócić swoich właściwości, ponieważ bezpośrednio przekształcają energię chemiczną, to znaczy energię odczynników (reduktora i utleniacza), które tworzą baterię, w energię elektryczną.
Odczynniki zawarte w akumulatorze są zużywane podczas jego działania, prąd stopniowo maleje, dlatego działanie źródła kończy się po całkowitym przereagowaniu odczynników.
Elementy alkaliczne i solne (baterie) są szeroko stosowane do zasilania różnych urządzeń elektronicznych, sprzętu radiowego, zabawek, a lit można najczęściej znaleźć w przenośnych urządzeniach medycznych, takich jak glukometry lub w technologii cyfrowej, takiej jak aparaty fotograficzne.

Baterie solne
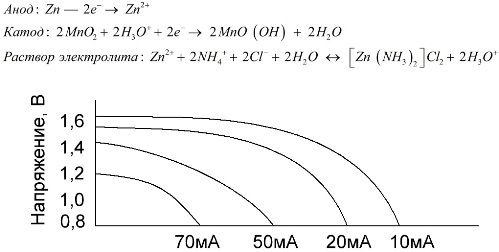
Ogniwa manganowo-cynkowe, zwane bateriami solnymi, są „suchymi” ogniwami galwanicznymi, w których nie ma ciekłego roztworu elektrolitu.
Elektroda cynkowa (+) jest katodą w kształcie miseczki, a anoda to sproszkowana mieszanka dwutlenku manganu z grafitem. Prąd przepływa przez pręt grafitowy. Jako elektrolit stosuje się pastę z roztworu chlorku amonu z dodatkiem skrobi lub mąki w celu zagęszczenia, dzięki czemu nic nie płynie.
Zazwyczaj producenci baterii nie podają dokładnego składu elementów solnych, jednak baterie solne są najtańsze, zwykle stosuje się je w urządzeniach, w których zużycie energii jest bardzo niskie: w godzinach, w pilotach zdalnego sterowania, w termometrach elektronicznych itp.

Pojęcie „pojemności nominalnej” jest rzadko stosowane w celu scharakteryzowania akumulatorów manganowo-cynkowych, ponieważ ich pojemność jest wysoce zależna od warunków i warunków eksploatacji. Głównymi wadami tych elementów są znaczne tempo redukcji napięcia podczas rozładowania i znaczny spadek pojemności wyjściowej wraz ze wzrostem prądu rozładowania. Ostateczne napięcie rozładowania jest ustawiane w zależności od obciążenia w zakresie 0,7-1,0 V.
Ważne jest nie tylko wielkość prądu rozładowania, ale także harmonogram obciążenia. W przypadku przerywanych wyładowań dużych i średnich prądów wydajność akumulatorów znacznie wzrasta w porównaniu do pracy ciągłej. Jednak przy małych prądach wyładowczych i miesiącach przerw w pracy ich pojemność może się zmniejszyć w wyniku samorozładowania.
Powyższy wykres pokazuje krzywe rozładowania dla przeciętnej baterii solnej przez 4, 10, 20 i 40 godzin dla porównania z baterią alkaliczną, co zostanie omówione później.
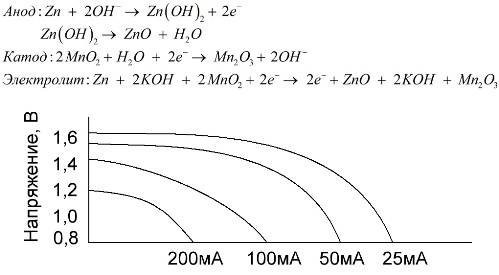
Baterie alkaliczne (alkaliczne)
Bateria alkaliczna to bateria galwaniczna manganowo-cynkowa, w której dwutlenek manganu stosuje się jako katodę, sproszkowany cynk stosuje się jako anodę, a roztwór alkaliczny stosuje się jako elektrolit, zwykle w postaci pasty wodorotlenku potasu.
Baterie te mają wiele zalet (w szczególności znacznie większą pojemność, lepszą wydajność w niskich temperaturach i wysokie prądy obciążenia).

Baterie alkaliczne w porównaniu z solą fizjologiczną mogą dostarczać więcej prądu przez długi czas. Większy prąd staje się możliwy, ponieważ cynk jest tu stosowany nie w postaci szkła, ale w postaci proszku o większej powierzchni kontaktu z elektrolitem. Wodorotlenek potasu w postaci pasty jest stosowany jako elektrolit.
Dzięki zdolności tego typu ogniw galwanicznych do dostarczania znacznego prądu (do 1 A) przez długi czas, baterie alkaliczne są obecnie najbardziej powszechne.
W zabawkach elektrycznych, w przenośnym sprzęcie medycznym, w urządzeniach elektronicznych, w aparatach wszędzie stosowane są baterie alkaliczne. Służą 1,5 razy dłużej niż sól fizjologiczna, jeśli rozładowanie jest niskim prądem. Wykres pokazuje krzywe rozładowania przy różnych prądach dla porównania z baterią solną (wykres podano powyżej) przez 4, 10, 20 i 40 godzin.
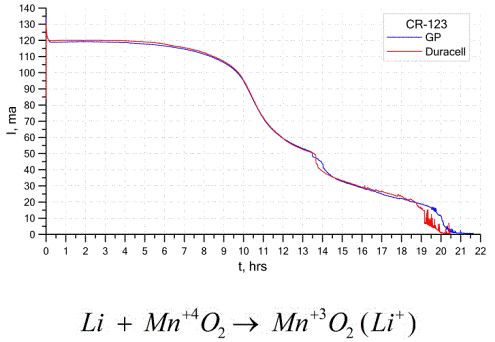
Baterie litowe
Innym dość powszechnym rodzajem ogniw galwanicznych są baterie litowe - pojedyncze nieładowalne ogniwa galwaniczne, w których lit lub jego związki są stosowane jako anoda. Ze względu na zastosowanie metalu alkalicznego mają dużą różnicę potencjałów.

Katoda i elektrolit ogniwa litowego mogą być bardzo różne, więc termin „ogniwo litowe” łączy grupę ogniw z tym samym materiałem anodowym.Jako katodę można na przykład zastosować dwutlenek manganu, monofluorek węgla, piryt, chlorek tionylu itp.
Baterie litowe odróżniają się od innych baterii wysokim czasem pracy i wysokimi kosztami. W zależności od wybranego rozmiaru i użytych materiałów chemicznych bateria litowa może wytwarzać napięcia od 1,5 V (kompatybilne z bateriami alkalicznymi) do 3,7 V.
Baterie te mają najwyższą pojemność na jednostkę masy i długi okres trwałości. Ogniwa litowe są szeroko stosowane w nowoczesnym przenośnym sprzęcie elektronicznym: do zasilania zegarków na płytach głównych komputerów, do zasilania przenośnych urządzeń medycznych, zegarków, kalkulatorów, w sprzęcie fotograficznym itp.
Powyższy wykres pokazuje krzywe rozładowania dla dwóch baterii litowych od dwóch popularnych producentów. Początkowy prąd wynosił 120 mA (na rezystor rzędu 24 omów).
Zobacz także: Nowoczesne akumulatory - zalety i wady
Zobacz także na e.imadeself.com
: