категории: Препоръчани статии » Новаци електротехници
Брой преглеждания: 52646
Коментари към статията: 4
Транзистори. Част 2. Проводници, изолатори и полупроводници
Начало на статията: История на транзистора, Транзистори: предназначение, устройство и принципи на работа
 В електротехниката се използват различни материали. Електрическите свойства на веществата се определят от броя на електроните във външната валентна орбита. Колкото по-малко електрони са в тази орбита, толкова по-слаби са свързани с ядрото, толкова по-лесно могат да отидат да пътуват.
В електротехниката се използват различни материали. Електрическите свойства на веществата се определят от броя на електроните във външната валентна орбита. Колкото по-малко електрони са в тази орбита, толкова по-слаби са свързани с ядрото, толкова по-лесно могат да отидат да пътуват.
Под влияние на температурните колебания, електроните се откъсват от атома и се движат в междутомното пространство. Такива електрони се наричат свободни и те създават електрически ток в проводниците. Има ли голямо междутомно пространство, има ли място за свободни електрони, които да пътуват вътре в материята?
Структурата на твърди течности и течности изглежда непрекъсната и плътна, напомняща по структура на кълбо нишка. Но всъщност дори солидите са по-скоро като мрежа за риболов или волейбол. Разбира се, това не може да се установи на ниво домакинство, но е установено с точни научни изследвания, че разстоянията между електроните и ядрото на атомите са много по-големи от техните собствени размери.
Ако размерът на атомното ядро е представен под формата на топка с размерите на футболна топка, тогава електроните в този модел ще бъдат с размер на грахово зърно и всеки такъв грах се намира от "сърцевината" на разстояние от няколкостотин и дори хиляди метра. А между ядрото и електрона е пустота - просто няма нищо! Ако си представим разстоянията между атомите на материята в един и същи мащаб, размерите изобщо ще се окажат фантастични - десетки и стотици километри!
Добрите проводници на електричество са метали, Например, атомите на златото и среброто имат само един електрон във външната орбита, следователно те са най-добрите проводници. Желязото също води електричество, но малко по-лошо.
Проведете електричество още по-зле сплави с висока устойчивост, Това са нихром, манганин, константан, фехрал и други. Такова разнообразие от високоустойчиви сплави се дължи на факта, че те са проектирани да решават различни проблеми: нагревателни елементи, тензодатчици, референтни резистори за измервателни уреди и много други.
За да се оцени способността на даден материал да провежда електричество, концепцията за "Електрическа проводимост", Връщаната стойност е съпротивление, В механиката тези понятия съответстват на специфичната гравитация.
изолаториза разлика от проводниците не са склонни да губят електрони. В тях връзката на електрона с ядрото е много силна и почти няма свободни електрони. По-точно, но много малко. В същото време в някои изолатори има повече от тях и съответно качеството им на изолация е по-лошо. Достатъчно е да се сравнят например керамиката и хартията. Следователно изолаторите могат условно да бъдат разделени на добри и лоши.
Появата на безплатни заряди дори в изолаторите се дължи на топлинни вибрации на електрони: под въздействието на висока температура изолационните свойства се влошават, някои електрони все пак успяват да се откъснат от ядрото.
По същия начин съпротивлението на идеалния проводник би било равно на нула. Но за щастие няма такъв проводник: представете си как би изглеждал законът на Ом ((I = U / R) с нула в знаменателя !!! Сбогом на математиката и електротехниката.
И само при абсолютна нулева температура (-273.2 ° C) топлинните колебания напълно спират и най-лошият изолатор става достатъчно добър. За да определите числено „това” е лошо - добре използвайте концепцията за съпротивление. Това е съпротивлението в ома на куб с дължина на ръба 1 cm, размерът на съпротивлението се получава в оми / cm. Специфичната устойчивост на някои вещества е показана по-долу.Проводимостта е реципрочна на съпротивлението, е мерната единица на Сименс, - 1Sm = 1 / Ohm.
Те имат добра проводимост или ниско съпротивление: сребро 1,5 * 10 ^ (- 6), прочетете как (един и половина до десет до мощността минус шест), мед 1,78 * 10 ^ (- 6), алуминий 2,8 * 10 ^ (- 6). Проводимостта на сплавите с висока устойчивост е много по-лоша: константан 0,5 * 10 ^ (- 4), нихром 1,1 * 10 ^ (- 4). Тези сплави могат да се нарекат лоши проводници. След всички тези сложни числа заменете Ohm / cm.
Освен това полупроводниците могат да бъдат разграничени като отделна група: германий 60 Ohm / cm, силиций 5000 Ohm / cm, селен 100 000 Ohm / cm. Съпротивлението на тази група е по-голямо от това на лошите проводници, но по-малко от това на лошите изолатори, да не говорим за добрите. Вероятно със същия успех полупроводниците могат да бъдат наречени полуизолатори.
След толкова кратко запознаване със структурата и свойствата на един атом, трябва да се помисли как атомите взаимодействат помежду си, как атомите взаимодействат помежду си, как се правят молекули от тях, от които са съставени различни вещества. За да направите това, отново ще трябва да запомните електроните във външната орбита на атома. В крайна сметка именно те участват в свързването на атомите в молекулите и определят физичните и химичните свойства на материята.
Как се правят атоми от атоми
Всеки атом е в стабилно състояние, ако в неговата външна орбита има 8 електрона. Той не се стреми да вземе електрони от съседни атоми, но и не се отказва от собствените си. За да проверите това, достатъчно е в периодичната таблица да разгледате инертните газове: неон, аргон, криптон, ксенон. Всеки от тях има 8 електрона във външната орбита, което обяснява нежеланието на тези газове да влизат във всякакви взаимоотношения (химически реакции) с други атоми, да изграждат молекули химикали.
Ситуацията е съвсем различна за онези атоми, които нямат 8 заветни електрона във външната си орбита. Такива атоми предпочитат да се обединят с други, за да допълнят външната си орбита с до 8 електрона и да намерят спокойно стабилно състояние.
Например добре познатата водна молекула H2O. Състои се от два водородни атома и един кислороден атом, както е показано на фигурата. 1.
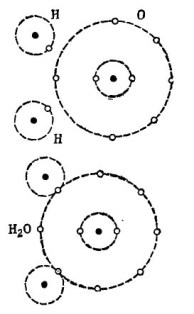
снимка 1, Как се създава водна молекула.
В горната част на фигурата са показани два водородни атома и един кислороден атом. Във външната орбита на кислород има 6 електрона и два електрона на два водородни атома са наблизо. Кислород, докато на заветното число 8 липсват само два електрона във външната орбита, които той ще получи, като добави към себе си два водородни атома.
На всеки водороден атом липсва 7 електрона във външната му орбита за пълно щастие. Първият водороден атом получава в своята външна орбита 6 електрона от кислород и друг електрон от своя близнак - вторият водороден атом. Сега във външната му орбита има 8 електрона, заедно с неговия електрон. Вторият водороден атом също завършва своята външна орбита до заветното число 8. Този процес е показан в долната част на фигурата. 1.
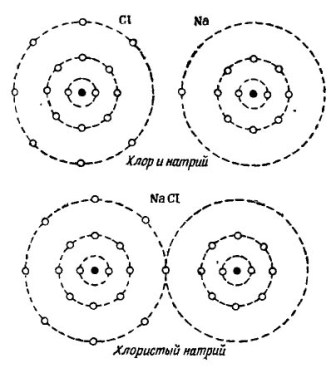
На снимката 2 Показан е процесът на комбиниране на натриеви и хлорни атоми. Резултатът е натриев хлорид, който се продава в магазините, наречени сол.
снимка 2, Процесът на комбиниране на натриеви и хлорни атоми
И тук всеки от участниците получава липсващия брой електрони от другия: хлорът прикрепя един натриев електрон към собствените си седем електрона, докато той дава своите атоми на натриевия атом. И двата атома във външната орбита имат 8 електрона, именно там се постига пълно съгласие и просперитет.
Валентност на атомите
Атомите с 6 или 7 електрона във външната си орбита са склонни да прикрепят 1 или 2 електрона към себе си. За такива атоми казват, че са едно или двувалентни. Но ако във външната орбита на атом 1, 2 или 3 електрона, такъв атом има тенденция да ги раздава. В този случай атомът се счита за един, два или тривалентен.
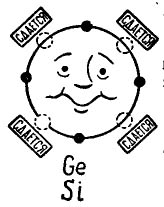
Ако във външната орбита на даден атом има 4 електрона, тогава такъв атом предпочита да се комбинира със същия, който също има 4 електрона. Ето как се комбинират германиеви и силициеви атоми, използвани при производството на транзистори. В този случай атомите се наричат тетравалентни. (Атомите на германий или силиций могат да се комбинират с други елементи, например кислород или водород, но тези съединения не са интересни в плана на нашата история.)
На снимката 3 показан е атом на германий или силиций, който желае да се комбинира със същия атом. Малките черни кръгове са собствените електрони на атома, а светлинните кръгове означават местата, където падат електроните на четирите атома - съседи.
снимка 3, Атом на германий (силиций).
Кристалната структура на полупроводниците
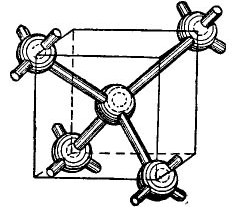
Германиевите и силициевите атоми в периодичната таблица са в същата група като въглерода (химическата формула на диамант С е просто големи въглеродни кристали, получени при определени условия) и следователно, когато се комбинират, образуват кристална структура, подобна на диамант. Формирането на такава структура е показано в опростена, разбира се, форма на фигурата 4.
снимка 4.
В центъра на куба е атом германий, а в ъглите са разположени още 4 атома. Атомът, изобразен в центъра на куба, е свързан от валентните си електрони към най-близките си съседи. На свой ред ъгловите атоми дават валентните си електрони на атома, разположен в центъра на куба и неговите съседи - атоми, които не са показани на фигурата. Така външните орбити се допълват от до осем електрона. Разбира се, в кристалната решетка няма куб, просто е показано на фигурата, така че взаимното, обемно разположение на атомите да е ясно.
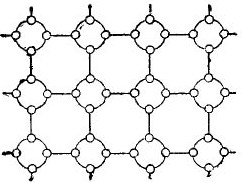
Но за да се опрости максимално историята за полупроводниците, кристалната решетка може да бъде изобразена под формата на плоска схематична рисунка, въпреки факта, че междутомните връзки все пак са разположени в пространството. Такава схема е показана на фигурата. 5.
снимка 5, Германската кристална решетка в плоска форма.
В такъв кристал всички електрони са здраво свързани с атомите чрез валентните си връзки, следователно, очевидно, тук просто няма свободни електрони. Оказва се, че пред нас е изолатор на фигурата, тъй като в нея няма свободни електрони. Но всъщност това не е така.
Вътрешна проводимост
Факт е, че под въздействието на температурата някои електрони все пак успяват да се откъснат от своите атоми и за известно време да се освободят от връзката с ядрото. Следователно, има малко количество свободни електрони в кристал на германий, поради което е възможно да се проведе електрически ток. Колко свободни електрона съществуват в кристал на германий при нормални условия?
Няма повече от два такива свободни електрона на 10 ^ 10 (десет милиарда) атома, така че германийът е лош проводник или както е обичайно да се казва полупроводник. Трябва да се отбележи, че само един грам германий съдържа 10 ^ 22 (десет хиляди милиарда) атома, което ви позволява да "вземете" около две хиляди милиарда свободни електрони. Изглежда, че достатъчно, за да премине голям електрически ток. За да се справите с този въпрос, достатъчно е да си припомним какъв ток от 1 А.
Ток от 1 A съответства на преминаването през проводник за една секунда електрически заряд от 1 кулон, или 6 * 10 ^ 18 (шест милиарда) електрона в секунда. На този фон две хиляди милиарда свободни електрони и дори разпръснати върху огромен кристал е малко вероятно да осигурят преминаването на високи токове. Въпреки че, поради топлинното движение, в Германия съществува малка проводимост. Това е така наречената вътрешна проводимост.
Електронна и дупкова проводимост
С повишаването на температурата допълнителна енергия се прехвърля към електроните, техните топлинни вибрации стават по-енергични, в резултат на което някои електрони успяват да се откъснат от своите атоми.Тези електрони стават свободни и при липса на външно електрическо поле извършват произволни движения и се движат в свободно пространство.
Атомите, които са загубили електрони, не могат да правят произволни движения, а само леко се колебаят спрямо нормалното си положение в кристалната решетка. Такива атоми, които са загубили електрони, се наричат положителни йони. Можем да предположим, че на мястото на електрони, откъснати от техните атоми, се получават свободни пространства, които обикновено се наричат дупки.
По принцип броят на електроните и дупките е един и същ, така че дупката може да улови електрон, който е наблизо. В резултат на това атом от положителен йон отново става неутрален. Процесът на комбиниране на електрони с дупки се нарича рекомбинация.
Със същата честота електроните се отделят от атомите, следователно, средно, броят на електроните и дупките за определен полупроводник е равен на, постоянен е и зависи от външните условия, особено от температурата.
Ако се приложи напрежение към полупроводниковия кристал, тогава движението на електроните ще бъде подредено, през кристала ще протече ток поради неговата електронна и дупкова проводимост. Тази проводимост се нарича вътрешна, тя беше спомената малко по-високо.
Но полупроводниците в чистата си форма, които имат електронна и дупкова проводимост, са неподходящи за производството на диоди, транзистори и други детайли, тъй като основата на тези устройства е преходът p-n (четете "pe-en").
За получаване на такъв преход са необходими два типа полупроводници, два вида проводимост (p - положителна - положителна, дупка) и (n - отрицателна - отрицателна, електронна). Тези видове полупроводници се получават чрез допинг, добавяне на примеси в чисти кристали на германий или силиций.
Въпреки че количеството на примесите е много малко, тяхното присъствие до голяма степен променя свойствата на полупроводника, ви позволява да получите полупроводници с различна проводимост. Това ще бъде разгледано в следващата част на статията.
Борис Аладишкин, electro-bg.tomathouse.com
Вижте също на electro-bg.tomathouse.com: