Kategorie: Vybrané články » Začátečníci elektrikáři
Počet zobrazení: 52646
Komentáře k článku: 4
Tranzistory Část 2. Vodiče, izolátory a polovodiče
Začátek článku: Historie tranzistorů, Tranzistory: účel, zařízení a principy činnosti
 V elektrotechnice se používají různé materiály. Elektrické vlastnosti látek jsou určeny počtem elektronů na vnější valenční orbitě. Čím méně elektronů je na této oběžné dráze, tím slabší jsou s jádrem, tím snáze mohou cestovat.
V elektrotechnice se používají různé materiály. Elektrické vlastnosti látek jsou určeny počtem elektronů na vnější valenční orbitě. Čím méně elektronů je na této oběžné dráze, tím slabší jsou s jádrem, tím snáze mohou cestovat.
Vlivem kolísání teploty se elektrony odtrhávají od atomu a pohybují se v interatomickém prostoru. Takové elektrony se nazývají volné a vytvářejí v vodičích elektrický proud. Existuje velký interatomický prostor, existuje prostor pro volné elektrony k cestování uvnitř hmoty?
Struktura pevných látek a kapalin se zdá být spojitá a hustá, připomínající strukturu koule vlákna. Ve skutečnosti jsou však i pevné látky spíš rybářské nebo volejbalové sítě. To samozřejmě nelze na úrovni domácnosti rozeznat, ale přesnými vědeckými studiemi bylo prokázáno, že vzdálenosti mezi elektrony a jádrem atomů jsou mnohem větší než jejich vlastní rozměry.
Pokud je velikost atomového jádra představována ve tvaru koule velikosti fotbalového míče, pak budou elektrony v tomto modelu velikost hrášku a každý takový hrášek je umístěn od „jádra“ ve vzdálenosti několika stovek až tisíců metrů. A mezi jádrem a elektronem je prázdnota - prostě není nic! Pokud si představíme vzdálenosti mezi atomy hmoty ve stejném měřítku, rozměry se ukážou jako fantastické - desítky a stovky kilometrů!
Dobré vodiče elektřiny jsou kovy. Například atomy zlata a stříbra mají na vnější oběžné dráze pouze jeden elektron, proto jsou nejlepší vodiče. Železo také vede elektřinu, ale o něco horší.
Vedení elektřiny ještě horší slitiny s vysokým odporem. Jsou to nichrom, mangan, konstantan, fechral a další. Taková řada vysoce odolných slitin je způsobena tím, že jsou navrženy tak, aby řešily různé problémy: topné články, tenzometry, referenční odpory pro měřicí přístroje a mnoho dalšího.
Aby se vyhodnotila schopnost materiálu vést elektřinu, pojem "Elektrická vodivost". Návratová hodnota je odpor. V mechanice tyto pojmy odpovídají specifické gravitaci.
IzolátoryNa rozdíl od dirigentů nejsou ochotni ztratit elektrony. V nich je vazba elektron-jádro velmi silná a téměř žádné volné elektrony neexistují. Přesněji, ale jen velmi málo. Zároveň je v některých izolátorech jich více a jejich izolační kvalita je tedy horší. Stačí srovnávat například keramiku a papír. Proto mohou být izolátory podmíněně rozděleny na dobré a špatné.
Vzhled volných nábojů i v izolátorech je způsoben tepelnými vibracemi elektronů: vlivem vysoké teploty se zhoršují izolační vlastnosti, některé elektrony se stále dokážou odtrhnout od jádra.
Podobně by odpor vodiče ideálního vodiče byl nulový. Ale naštěstí takový dirigent neexistuje: představte si, jak by Ohmův zákon (I = U / R) vypadal s nulou ve jmenovateli !!! Rozloučení s matematikou a elektrotechnikou.
A pouze při absolutní nulové teplotě (-273,2 ° C) se tepelné fluktuace zcela zastaví a nejhorší izolátor se stane dostatečně dobrým. Aby bylo možné numericky zjistit „to“ je špatné - použijte koncept odporu. Toto je odpor krychle s délkou hrany 1 cm v Ohmech, rozměr odporu je získán v ohmech / cm. Specifická odolnost některých látek je uvedena níže.Vodivost je vzájemná hodnota odporu, je měrnou jednotkou Siemens, - 1Sm = 1 / Ohm.
Mají dobrou vodivost nebo nízkou rezistivitu: stříbro 1,5 * 10 ^ (- 6), přečtěte jak (jeden a půl až deset na sílu mínus šest), měď 1,78 * 10 ^ (- 6), hliník 2,8 * 10 ^ (- 6). Vodivost slitin s vysokým odporem je mnohem horší: konstanta 0,5 * 10 ^ (- 4), nichrom 1,1 * 10 ^ (- 4). Tyto slitiny lze nazvat špatnými vodiči. Po všech těchto složitých číslech nahraďte Ohm / cm.
V samostatné skupině lze dále rozlišovat polovodiče: germanium 60 Ohm / cm, křemík 5000 Ohm / cm, selen 100 000 Ohm / cm. Odpor této skupiny je větší než odpor špatných dirigentů, ale menší než odpor špatných izolátorů, nemluvě o dobrých. Pravděpodobně by se stejným úspěchem mohly být polovodiče označovány jako poloizolátory.
Po tak krátkém seznámení se strukturou a vlastnostmi atomu je třeba zvážit, jak atomy spolu vzájemně reagují, jak atomy interagují spolu navzájem, jak jsou z nich molekuly, ze kterých jsou složeny různé látky. K tomu budete muset znovu zapamatovat elektrony na vnější oběžné dráze atomu. Koneckonců, oni se účastní vazby atomů na molekuly a určují fyzikální a chemické vlastnosti hmoty.
Jak jsou atomy vyráběny z atomů
Každý atom je ve stabilním stavu, pokud je na jeho vnější oběžné dráze 8 elektronů. Nesnaží se vzít elektrony ze sousedních atomů, ale nevzdává se svých vlastních. K ověření toho stačí v periodické tabulce podívat se na inertní plyny: neon, argon, krypton, xenon. Každý z nich má na vnější oběžné dráze 8 elektronů, což vysvětluje neochotu těchto plynů vstoupit do jakýchkoli vztahů (chemických reakcí) s jinými atomy a vytvářet molekuly chemikálií.
Situace je úplně jiná u těch atomů, které na své vnější oběžné dráze nemají 8 drahých elektronů. Takové atomy raději spojí s ostatními, aby doplnila jejich vnější orbitu až o 8 elektronů a najít klidný stabilní stav.
Například dobře známá molekula vody H2O. Skládá se ze dvou atomů vodíku a jednoho atomu kyslíku, jak je znázorněno na obrázku. 1.
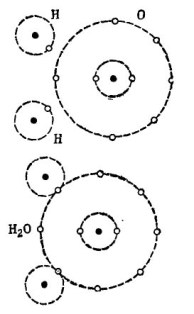
Kresba 1. Jak se vytváří molekula vody.
V horní části obrázku jsou samostatně zobrazeny dva atomy vodíku a jeden atom kyslíku. Na vnější oběžné dráze kyslíku je 6 elektronů a poblíž jsou dva elektrony na dvou atomech vodíku. Kyslík dokud nezachrání číslo 8, na vnější oběžné dráze chybí jen dva elektrony, které obdrží přidáním dvou atomů vodíku k sobě.
Každý atom vodíku postrádá na své vnější oběžné dráze 7 elektronů pro úplné štěstí. První atom vodíku přijímá na své vnější oběžné dráze 6 elektronů z kyslíku a další elektron ze svého dvojče - druhý atom vodíku. Nyní je na jeho vnější oběžné dráze spolu s elektronem 8 elektronů. Druhý atom vodíku také dokončuje svou vnější orbitu na vyhledávané číslo 8. Tento proces je zobrazen ve spodní části obrázku. 1.
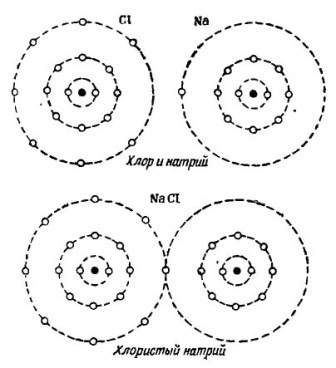
Na obrázku 2 Je ukázán proces kombinace atomů sodíku a chloru. Výsledkem je chlorid sodný, který se prodává v obchodech zvaných sůl.
Kresba 2. Proces kombinace atomů sodíku a chloru
I zde obdrží každý z účastníků chybějící počet elektronů od druhého: chlor připojí jediný sodíkový elektron ke svým sedmi elektronům, zatímco atomům sodíku dá atomy. Oba atomy na vnější oběžné dráze mají 8 elektronů, což je místo, kde je dosaženo plné shody a prosperity.
Valence atomů
Atomy se 6 nebo 7 elektrony na své vnější oběžné dráze mají sklon k sobě připevňovat 1 nebo 2 elektrony. Říkají o takových atomech, že jsou jeden nebo dvojmocný. Ale pokud na vnější oběžné dráze atomu 1, 2 nebo 3 elektrony, pak takový atom má tendenci je rozdávat. V tomto případě je atom považován za jeden, dva nebo trojmocné.
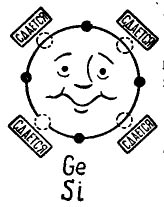
Pokud jsou na vnější oběžné dráze atomu 4 elektrony, pak se takový atom přednostně kombinuje se stejným elektronem, který má také 4 elektrony. Takto se kombinují atomy germania a křemíku používané při výrobě tranzistorů. V tomto případě se atomy nazývají čtyřmocné. (Atomy germania nebo křemíku lze kombinovat s jinými prvky, například s kyslíkem nebo vodíkem, ale tyto sloučeniny nejsou v plánu našeho příběhu zajímavé.)
Na obrázku 3 je zobrazen atom germania nebo křemíku, který chce kombinovat se stejným atomem. Malé černé kruhy jsou atomy vlastní elektrony a světlé kruhy označují místa, kde padají elektrony čtyř atomů - sousedů -.
Kresba 3. Atom germania (křemík).
Krystalová struktura polovodičů
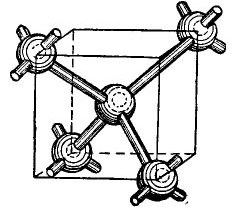
Atomy germania a křemíku v periodické tabulce jsou ve stejné skupině s uhlíkem (chemický vzorec diamantu C je prostě velké krystaly uhlíku získané za určitých podmínek), a proto, pokud jsou kombinovány, vytvářejí krystalickou strukturu podobnou diamantu. Vytvoření takové struktury je znázorněno ve zjednodušené, samozřejmě formě na obrázku 4.
Kresba 4.
Ve středu krychle je atom germania a v rozích jsou umístěny další 4 atomy. Atom zobrazený ve středu krychle je vázán svými valenčními elektrony k nejbližším sousedům. Úhlové atomy zase dávají své valenční elektrony atomu umístěnému ve středu krychle a jejím sousedům - atomům neuvedeným na obrázku. Vnější dráhy jsou tak doplněny až osmi elektrony. V krystalové mřížce samozřejmě není žádná krychle, je to pouze znázorněno na obrázku, takže vzájemné objemové uspořádání atomů je jasné.
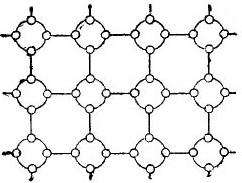
Aby se však co nejvíce zjednodušil příběh o polovodičích, lze krystalovou mřížku znázornit jako plochý schematický nákres, přestože interatomické vazby jsou přesto umístěny v prostoru. Takový obvod je znázorněn na obrázku. 5.
Kresba 5. Krystalová mříž germania v ploché formě.
V takovém krystalu jsou všechny elektrony pevně připojeny k atomům jejich valenčními vazbami, proto zde zjevně neexistují žádné volné elektrony. Ukazuje se, že před námi je na obrázku izolátor, protože v něm nejsou žádné volné elektrony. Ale ve skutečnosti tomu tak není.
Vnitřní vodivost
Skutečnost je taková, že pod vlivem teploty se některým elektronům stále podaří odtrhnout se od atomů a na nějakou dobu se uvolnit z vazby s jádrem. Proto v germaniovém krystalu existuje malé množství volných elektronů, díky čemuž je možné vést elektrický proud. Kolik volných elektronů existuje v germaniovém krystalu za normálních podmínek?
Neexistují více než dva takové volné elektrony na 10 ^ 10 (deset miliard) atomů, takže germanium je chudý dirigent, nebo jak je obvyklé říkat polovodič. Je třeba poznamenat, že pouze jeden gram germania obsahuje 10 ^ 22 (deset tisíc miliard miliard) atomů, což vám umožňuje „získat“ asi dva miliardy miliard volných elektronů. Zdá se, že dost na to, aby projel velkým elektrickým proudem. K řešení tohoto problému stačí si vzpomenout, jaký proud 1 A.
Proud 1 A odpovídá průchodu vodiče za jednu sekundu elektrickým nábojem 1 Coulomb, nebo 6 * 10 ^ 18 (šest miliard miliard) elektronů za sekundu. V této souvislosti je nepravděpodobné, že by dva tisíce miliard volných elektronů, a to i rozptýlených po obrovském krystalu, zajistilo průchod vysokých proudů. Přestože v Německu existuje tepelná pohyblivost, existuje malá vodivost. Toto je tzv. Vnitřní vodivost.
Elektronická vodivost a vodivost děr
Jak teplota stoupá, další energie je přenášena na elektrony, jejich tepelné vibrace se stávají energetičtějšími, v důsledku čehož se některým elektronům podaří odtrhnout se od jejich atomů.Tyto elektrony se uvolní a při absenci vnějšího elektrického pole vytvářejí chaotické pohyby a pohybují se ve volném prostoru.
Atomy, které ztratily elektrony, nemohou provádět náhodné pohyby, ale jen nepatrně oscilují vzhledem ke své normální poloze v krystalové mřížce. Takové atomy, které ztratily elektrony, se nazývají kladné ionty. Můžeme předpokládat, že místo elektronů vytržených z jejich atomů se získají volné prostory, které se běžně nazývají díry.
Obecně je počet elektronů a děr stejný, takže díra může zachytit elektron, který je poblíž. V důsledku toho se atom z pozitivního iontu opět stane neutrálním. Proces kombinování elektronů s otvory se nazývá rekombinace.
Při stejné frekvenci jsou elektrony odděleny od atomů, proto je počet elektronů a děr pro určitý polovodič v průměru roven, je konstantní a závisí na vnějších podmínkách, zejména teplotě.
Pokud je na polovodičový krystal přivedeno napětí, bude uspořádán pohyb elektronů, krystal bude protékat proudem díky jeho vodivosti elektronů a děr. Tato vodivost se nazývá vnitřní, byla již zmíněna o něco vyšší.
Čisté polovodiče s elektronickou vodivostí a vodivostí děr jsou však nevhodné pro výrobu diod, tranzistorů a dalších detailů, protože základem těchto zařízení je spojení p-n (přečtěte si „pe-en“).
K dosažení takového přechodu jsou zapotřebí dva typy polovodičů, dva typy vodivosti (p - pozitivní - pozitivní, díra) a (n - negativní - negativní, elektronické). Tyto typy polovodičů se získají dotováním, přidáním nečistot k čistým krystalům germania nebo křemíku.
Přestože je množství nečistot velmi malé, jejich přítomnost do značné míry mění vlastnosti polovodiče, umožňuje získat polovodiče různé vodivosti. To bude probráno v další části článku.
Boris Aladyshkin, https://e.imadeself.com/cs
Viz také na e.imadeself.com
: